Методика проведения ангиопластики
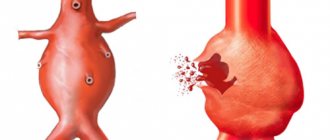
Процедура ангиопластики заключается в том, что пациенту, через прокол в коже к месту стеноза проводится проводник, через который вводится катетер с крошечным баллоном на конце.
Под давлением баллончик надувается и “раздавливает” атеросклеротическую бляшку.
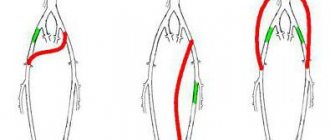
Чаще всего для проведения данной процедуры используется доступ к стенозированным сосудам через бедренную артерию в паховой области. Эта методика технически проще, чем через лучевую артерию в области запястья (радиальный доступ). Однако при радиальном доступе послеоперационный период практически отсутствует и пациент сразу же может вести активный образ жизни.
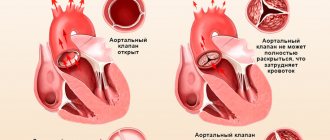
В настоящее время широко используется ангиопластика со стентированием. Для данной процедуры используются баллонные катетеры с расположенной вокруг баллона циркулярной металлической сеточкой – стентом. Стент находится в спавшемся состоянии и при надувании баллона расправляется в суженном участке. Просвет расширяется и кровоток восстанавливается. Стент остается в сосуде, как опорный каркас. Катетер удаляется.
Процедура проводится под постоянным рентгенкотролем, после введения рентгенкотрастного вещества, которое делает сосуд видимым.
Проводится вмешательство рентгенэндоваскулярным хирургом в рентгеноперационной.
Процедура ангиопластики безболезненна и продолжается от 1 до 3 часов.
Видео: ангиопластика со стентированием – медицинская анимация
Техника проведения операции
Транслюминальная баллонная ангиопластика считается малоинвазивной манипуляцией, поэтому выполняется в катетеризационной операционной. Для её выполнения не требуется общая анестезия – хирург самостоятельно обезболивает местным анестетиком точку пункции сосуда. Несмотря на это, в операционной всегда присутствует анестезиолог, чтобы при возможном возникновении внештатной ситуации оказать пациенту своевременную помощь.
Больного кладут на операционный стол, придавая ему положение «на спине». Далее следует подключение приборов, измеряющих артериальное давление, насыщение крови кислородом, частоту пульса пациента. Следующим этапом будет пункция и катетеризация периферической вены для введения необходимых медикаментов, инфузии растворов. Кожу на месте прокола хирург обрабатывает антисептиками, а затем накрывает стерильным операционным бельём. Когда операционное поле подготовлено, врач проводит местное обезболивание.
Первоначально хирург выполняет прокол сосуда и устанавливает в его просвет проводник. Затем удаляет пункционную иглу, а через мягкий проводник вводит баллонный катетер. Контролируя процесс продвижения катетера с помощью рентгеновского излучения, хирург проводит его вдоль сосуда к тому месту, где предположительно находится участок стеноза. По достижении цели в кровоток вводится контрастирующий агент, после чего выполняется снимок.
Когда место стеноза верифицировано, баллонный катетер продвигается к нему под рентгенологическим контролем. Достигнув намеченной цели, хирург надувает и быстро сдувает манжету баллончика. Тем самым достигается вазодилатационный эффект. Внутри баллончика находится стент. Он представляет собой мягкую металлическую сеточку, сложенную в форме трубки. После раздувания манжеты стент раскрывается, плотно прилегая к сосудистой стенке. Устройство поддерживает сосудистый просвет открытым, не позволяет ему повторно стенозироваться.
После постановки стента хирург выполняет контрольный снимок, чтобы оценить его положение, а также степень реваскуляризации. При удовлетворительном результате баллонный катетер изымается из сосудистого просвета. На место прокола накладывается давящая стерильная повязка. Пациента на каталке перевозят в послеоперационную палату.
Лазерная ангиопластика выполняется по такому же алгоритму. Её отличие состоит в том, что жировые бляшки полностью разрушаются лазером. Расширяющее устройство не устанавливается.
Коронарная ангиопластика сосудов сердца
Чтобы восстановить кровообращение в сосудистой сети, кровоснабжающей сердечную мышцу, выполняется ангиопластика коронарных артерий (коронарная ангиопластика). Это эффективный метод помощи пациентам с ИБС, особенно осложнившейся инфарктом.
Коронарная реваскуляризация миокарда с применением стентов значительно улучшает исходы после стенозирования или обтурации венечных артерий. При выполнении ТЛБАП расширяющее устройство чаще всего устанавливается в ПМЖВ (передней межжелудочковой ветви венечной артерии, кровоснабжающей сердце). Для этого используется катетер баллонный для коронарной ангиопластики стандартный.
После операции больным назначаются медикаментозные средства, улучшающие кровоток, понижающие риск тромбообразования. Транслюминальная баллонная коронарная ангиопластика (ТБКА) считается успешной, если после контрольной оценки результата остаточное сужение сосудистого просвета составляет не более 18-20%. Также об успехе можно говорить, когда пациент после восстановления отмечает регресс симптомов, указывающих на ишемию.
Показания к проведению ангиопластики
Наиболее частое применение ангиопластика нашла при стенозирующем атеросклерозе сосудов сердца (коронарная ангиопластика); сосудов ног; сосудов, участвующих в кровоснабжении головного мозга и тканей головы; стенозе почечных артерий.
Методы выявления стенозирующего атеросклероза сосудов
- Дуплексное ультразвуковое исследование сосудов
- Компьютерная томография
- Магнитно – резонансная томография
При выявлении стенозирующего атеросклероза в ряде случаев может быть назначена ангиография. При проведении ангиографии возможно одновременно провести и процедуру ангиопластики.
Когда делается выбор в пользу хирургического лечения?
Выбор в пользу хирургического лечения сужения сосуда принимается при выявлении выраженного стеноза, при котором диаметр сосуда уменьшается более, чем на 50% (гемодинамически значимый стеноз). При таком стенозе развивается кислородное голодание тканей (ишемия) за счет выраженного уменьшения кровотока.
Клинические проявления ишемии зависят от пораженного сосуда:
- Ишемическая болезнь сердца – при поражении коронарных артерий
- Боли в икроножных мышцах, язвы и гангрена нижних конечностей – в случае атеросклеротических изменений в сосудах ног
- Транзиторные ишемические атаки, кратковременные потери сознания – при сужении сонных артерий
- Повышение артериального давления – при стенозе почечных артерий.
Показания и противопоказания к назначению
Став в последнее время самым популярным и действенным лечением инфаркта миокарда, будучи лучшей альтернативой шунтированию и медикаментозной терапии, его применение все также ограничено рядом строгих на то показаний.
Это:
- Бессимптомная ишемия. В данную группу входят пациенты с одной-двумя пораженными венечными артериями и подтвержденной инструментально и лабораторно ишемией сердечной мышцы.
Внимание! Бессимптомное течение миокардиальной ишемии и инфаркта миокарда в частности наиболее характерно для пациентов с сахарным диабетом.
- Нестабильная стенокардия или стабильная средней тяжести. Стабильная стенокардия, симптомы которой относят ее к II-IV классу по степени тяжести, или же нестабильная стенокардия требуют не только ангиографии, но и проведения ангиопластики.
- STEMI. Инфаркт миокарда с элевацией сегмента ST выше изолинии – «красный флаг», требующий срочной терапии, наиболее действенной из которых является пластика сосуда сердца. При этом индивидуальные особенности, как самого пациента, так и его состояния на момент инфаркта и обширности некроза играют важную роль в выборе данного метода.
- Проведенное ранее шунтирование. Пациенты, в анамнезе которых есть перенесенное раннее шунтирование, поступающие в лечебное учреждение с симптомами стенокардии должны рассматриваться как кандидаты на проведение ангиопластики.
Теоретически повторное шунтирование возможно, однако оно несет за собой высокие риски неблагоприятных осложнений.
При загрудинной боли требуется консультация кардиолога.
Противопоказания для проведения ангиопластики
Основными ситуациями, при которых не применяется данный вид терапии ишемии миокарда считаются следующие:
- окклюзия сосуда, диаметр которого уменьшен менее чем на 50% от должного просвета;
- стеноз основного ствола левой коронарной артерии;
- клинически значимая окклюзия трех и более коронарных артерий.
Последние два фактора являются показаниями для направления больного на оперативное вмешательство открытого типа – шунтирование.
Другие противопоказания включают в себя определенные состояния здоровья пациента, например, нарушенное свертывание крови, застойная сердечная недостаточность в стадии декомпенсации, почечная недостаточность, острое нарушение мозгового кровообращения и т.д.
Коронарная ангиопластика
Коронарная ангиопластика используется для восстановления проходимости коронарных артерий и нормального функционирования сердца, как при стенокардии, так и при остром инфаркте миокарда.
Появление стентов увеличило число пациентов, которые могут быть подвергнуты чрескожному коронарному вмешательству. При использовании стентов и современной медикаментозной терапии, показатели успешно выполненной коронарной ангиопластики достигают 90-95%.
Об успешном проведении процедуры ангиопластики можно говорить, если по данным ангиографии после вмешательства остаточный стеноз в пораженном сосуде составил 20% и полностью восстановился кровоток в артерии, процедура прошла без серьезных осложнений, уменьшились признаки и симптомы ишемии после того, как пациент восстановился после операции.
Осложнения чрескожных коронарных вмешательств
Серьезные осложнения встречаются редко и чаще всего наблюдаются в случае поступления пациентов в остром периоде инфаркта миокарда, в тяжелом состоянии с кардиогенным шоком, с множественным поражением коронарных сосудов и значительными изменениями в мышце сердца, тяжелым атеросклерозом периферических артерий.
Незначительные осложнения – преходящая ишемическая атака, осложнения в месте доступа, почечная недостаточность и неблагоприятная реакция на контрастное вещество.
Рестеноз – что это такое?
рестеноз
После ангиопластики в период между третьим и шестым месяцами может произойти повторное сужение сосуда в том же месте – рестеноз.
Рестеноз считается не осложнением ангиопластики, а скорее ответом сосудистой стенки на эндоваскулярное вмешательство.
Несколько слов о стентах
При проведении коронарной ангиопластики используются:
- Простые металлические (без лекарственного покрытия) стенты;
- Стенты, выделяющие лекарственное вещество – это стенты, покрытые специальным полимером на стенке стента, контактирующей с сосудом, и дозировано выделяющим лекарственное вещество, препятствующее развитию рестеноза;
- Биодеградируемые (саморассасывающиеся) стенты – при установке они расширяют просвет артерии, в течение трех месяцев выделяют лекарство, которое препятствует процессу рестеноза. А через два года биодеградируемые стенты рассасываются.
Каждый вид стента подбирается индивидуально, по показаниям, учитывая пожелания пациента и в соответствии со всеми особенностями течения заболевания.
С появлением стентов, выделяющих лекарства, частота возникновения рестонозов после коронарной ангиопластики составляет менее 10%.
Лазерная ангиопластика – методика, используемая при технической невозможности проведения баллонной ангиопластики.
Применение лазера имеет свои показания: в случаях сильного обызвествления атеросклеротических бляшек, протяженных и расположенных в устьях коронарных сосудов, а также бляшек, полностью закрывающих просвет сосуда. Принцип методики тот же, что и баллонной ангиопластики, но используется лазерный датчик, а не катетер с баллоном. Лазер воздействует на бляшку высокой температурой и бляшка испаряется. После этого в сосуд вводится стент.
Ведение пациента после процедуры
Благодаря распространенным в последнее время специальным устройствам, закрывающим прокол в артерии, удаление проводниковой оболочки, установленной в месте артериального доступа, возможно сразу по окончанию манипуляции. После этого пациент остается в постели от 18 до 24 часов в среднем при отсутствии осложнений.
Чрезкожную ангиопластику обычно ведут одновременно два специалиста-кардиолога.
В случае, если в течение процедуры пациенту вводился блокатор гликопротеинов IIb/IIIa, его продолжают давать на протяжении еще 18 часов после окончания ангиопластики.
Аспирин и Клопидогрел дается также пациенту после операции, причем длительность лечения и дозировка последнего различается в зависимости от вида использованного стента. Так при установке металлического стента прием Клопидогрела продолжается до 2-4 недель, а если был установлен стент с покрытием лекарственным веществом – прием данного лекарственного препарата удлиняется на срок от 3 до 6 месяцев.
Важно! Отсутствие симптомов ишемии миокарда ожидается сразу после установки стента.
Ангиопластика сонных артерий
Ангиопластика со стентированием сонных артерий — одно из наиболее перспективных и сложных направлений в эндоваскулярной хирургии по восстановлению кровоснабжения головного мозга.
Хирургическое вмешательство на сонных артериях показано при сужении сонных артерий 60% и более при наличии таких симптомов, как транзиторные ишемические атаки, синкопальные состояния или перенесенный инсульт. При сужении сонных артерий более 70% даже при отсутствии явной симптоматики показано оперативное лечение.
ангиопластика сонных артерий со стентированием
Выбор хирургического лечения – открытое оперативное лечение (эндартерэктомия) или ангиопластика со стентированием – задача первостепенной важности, как у пациентов с симптомами заболевания. так и у «бессимптомных» пациентов.
Сдерживающим фактором, проведения ангиопластики со стентированием сонных артерий является высокий риск возможной эмболии сосудов головного мозга во время операции. Изобретение специальных окклюзионных баллонов и фильтров, располагаемых дистальнее места операции, значительно снижает частоту эмболии и инсульта.
В настоящее время разработаны четкие рекомендации по выбору метода хирургического лечения в зависимости от степени стеноза, места расположения и структуры атеросклеротической бляшки, а также сопутствующей патологии.
Транслюминальная баллонная ангиопластика у больных с различными формами ИБС, (обзор литературы).
Введение: Ишемическая болезнь сердца – по-прежнему занимает ведущие позиции в структуре заболеваемости и смертности населения развитых индустриальных стран, несмотря на достигнутые за последнее десятилетие впечатляющие успехи в профилактике и лечении ИБС. В основе ИБС, как известно, лежит стенозирующий атеросклероз венечных артерий, который встречается примерно у 98% больных. В связи с этим, одним из перспективных направлений лечения ИБС явилась реперфузионная терапия. Восстановление кровотока по артерии сердца, пораженной атеросклерозом, является конечной целью 3−х принципиальных направлений реперфузионной терапии: системного тромболизиса, коронарной ангиопластики и АКШ. Восстановление кровотока в синдром-связанной артерии с помощью коронарной ангиопластики достигается без оперативной травмы и быстро, как при тромболизисе, и вместе с тем полноценно, как при хирургической реваскуляризации (Spencer B. King, 1996). Коронарная ангиопластика является методом, позволяющим сочетать положительные стороны других методов лечения. Она все чаще выступает в качестве метода выбора при лечении больных с острыми формами ИБС и является экономически более выгодной (Grinmes S. et al., 1996; Zjilstra F., 1995). Современное состояние проблемы транслюминальной баллонной ангиопластики у больных с разными формами ИБС Одним из эффективных и наиболее часто применяемых методов эндоваскулярной реваскуляризации миокарда в интервенционной кардиологии в настоящее время является транслюминальная баллонная коронарная ангиопластика. Метод разработан и внедрен в клиническую практику A.Gruentzig в 1977 году. Первоначально ТЛАП применялся у больных с хронической стабильной стенокардией, затем его все чаще стали применять при нестабильной стенокардии и в остром периоде инфаркта миокарда, (Иоселиани Д.Г., 1982, 1992; O. Kamp 1989). Технический успех коронарной ангиопластики при нестабильной стенокардии не отличается от такового при лечении больных со стабильной стенокардией, однако, частота тяжелых осложнений существенно увеличивается (Holmes D.R., 1985; Bentvoglio L.G., 1991). Вопрос об эффективности ТЛАП при ОИМ остается спорным. Ряд авторов (Иоселиани Д.Г., 1993, 1995., Dzhorgova-Lu, 1995) считают метод прямой реваскуляризации миокарда в острую стадию инфаркта миокарда эффективным, другие исследователи (Тopol E., 1980; Rainzer A.E., 1985) не находят положительных результатов. Имеются даже сообщения (Reimer K. A., 1981), что эта процедура может оказывать неблагоприятное действие на течение ОИМ вследствие расширения зоны некроза. Традиционно считалось, что проведение ТЛАП в первую очередь показано больным с изолированным поражением проксимального или среднего сегментов одной (реже двух) ветви коронарной артерии сердца (Иоселиани Д.Г., 1993; Yambe T., 1991). Однако постоянное техническое совершенствование способствовало тому, что выполнение ТЛАП стало возможным и у больных с поражением нескольких сегментов всех 3−х основных артерий. В настоящее время показанием для проведения ТЛАП служит ишемия миокарда, связанная со стенозом коронарной артерии. Кандидатом на проведение баллонной ангиопластики может быть любой больной с симптомами стенокардии и объективным подтверждением выраженной ишемии миокарда, без особых возрастных ограничений (Эха Я.Э. и соавт., 1984; Cheng G.S. et al, 1993; Joel K. Kahn 1993). Факторы, влияющие на выживаемость больных в отдаленном периоде после баллонной ангиопластики коронарных артерий. При оценке эффективности ТЛАП в отдаленном периоде, традиционно принято использовать несколько критериев: выживаемость, отсутствие приступов стенокардии, предупреждение ОИМ и потребность в дополнительных процедурах. Большинство зарубежных исследователей (Joel K. Kahn, 1990; Gregg W. Ston, 1995; Kotaro Sumii, 1993) установили, что ТЛАП благоприятно влияет на отдаленную выживаемость больных, отмечая при этом высокий процент выживаемости: 95%, 87% и 82% через 1 год, 4 года и 7 лет соответственно, по сравнению с 80%, 69% и 65% выживаемости при безуспешной ТЛАП. Спорным остается вопрос о влиянии на отдаленную выживаемость количества пораженных артерий. Отдаленная выживаемость у больных с многососудистым поражением коронарного русла ниже, чем у больных с однососудистым поражением коронарного русла. (K. Detre et al., Toraxcenter, 1986). Не найдено существенной разницы в выживаемости больных после ТЛАП, выполненной при различных формах ИБС: стабильная и нестабильная стенокардия, ОИМ.( Toraxcenter 1986; S. M. Scott et al., 1994; О. Камр еt al., 1989; M. Naqui Sabri,1992; David W.M. Muller,1990). У больных с множественным поражением коронарных артерий баллонная ангиопластика является более трудоемкой и продолжительной по времени процедурой, а также у них существует большая вероятность рестеноза и реокклюзии. По мнению ряда авторов (Иоселиани Д.Г с соавт., 1997) при планирование проведения ангиопластики у больных с множественным поражением коронарных сосудов необходимо выявить стенозы, ответственные за возникновение симптомов стенокардии, и их следует дилятировать в первую очередь. Необходимо также определить сосуды, роль которых в возникновении ишемии и симптомов стенокардии незначительна и соответственно дилятация которых не будет играть существенной роли у данного больного. Большое значение имеет также определение последовательности дилятации сосудов и возможности поэтапной ТЛАП. В таблица №1 представлены сводные показатели отдаленной выживаемости больных после успешной транслюминальной баллонной ангиопластики. Анализ литературы показал достоверную зависимость отдаленной выживаемости от состояния сократительной функции ЛЖ. Как видно из приведенных ниже данных, более благоприятные показатели выживаемости наблюдаются в группе больных с ОФВ ЛЖ * 50%. Т. Sterens (1991) изучил отдаленную выживаемость при выполнение ТЛАП у больных с дисфункцией ЛЖ (ОФВ ЛЖ < 40% по данным ВГ). Через 1 и 4 года отдаленная выживаемость составила 87% и 69%, соответственно. Hochbert Y. et al. (1996) сравнил отдаленную выживаемость пациентов с ОФВ ЛЖ * 20% и с ОФВ ЛЖ * 20%. Через 3 года она составила 60% и 15%, соответственно. Группа исследователей из Toraxcenter (1986) опубликовала работу, в которой представлены данные по общей выживаемости пациентов после ТЛАП в зависимости от функционального состояния ЛЖ. Через 5 и 10 лет она составляла 91% и 80%, соответственно, для больных с ОФВ ЛЖ * 50%, и 79 % и 57% – для больных с ОФВ ЛЖ * 50% (р * 0,0005). Многие авторы подчеркивают, что летальность при проведении ангиопластики ниже, чем при медикаментозном лечении сравниваемых по тяжести поражения больных. Е. Berger (1992) сравнил смертность при ТЛАП через 18 мес. и она составила 1%, при АКШ 4% и при консервативном лечение 6% через 27 мес. Менее значительная разница в цифрах летальности между ТЛАП и АКШ наблюдалась в исследованиях Т. Hamaguchi et al. (1995). Через 3 года она составила 3% и 5%, соответственно. Высокая летальность в отдаленные сроки наблюдалась в исследованиях CASS, где 15−летняя смертность после АКШ составила 22%, а при консервативном лечении 15%. Таким образом, на успех процедуры и отдаленные результаты реваскуляризации миокарда влияют характер поражения коронарной артерии, подвергшейся ТЛАП, функциональное состояние миокарда и выбранный метод лечения. Транслюминальная баллонная ангиопластика в настоящее время является самым безопасным методом лечения ИБС, так как имеет более низкую отдаленную летальность в сравнении с АКШ и консервативным лечением. Различные аспекты качества жизни больных в отдаленном периоде после баллонной ангиопластики. Представляют особый интерес исследования, в которых изучены проблемы возникновения стенокардии и развития нефатальных ОИМ в бассейне или вне бассейна дилятированной артерии у больных, подвергшихся ТЛАП. Хотя баллонная ангиопластика способствует открытию сосуда и сохранению функции ЛЖ, остается спорным вопрос, приводит ли она к более благоприятному клиническому течению заболевания в сравнении с другими методами лечения. Под качеством жизни подразумевается удовлетворенность человека своим физическим, психическим и социальным благополучием (Гладков А.П. с соавт., 1982г., Леви Л., Андерсон А. 1979г., Г.Ф. Мухамеджанова с соавт., 1996г.). Одной из составляющих аспектов качества жизни является клиническое состояние (выживаемость, отсутствие эпизодов стенокардии, повышение толерантности к физической нагрузке) больного в отдаленном периоде после ТЛАП. Большинство авторов (Бабунашвили В.М., Рабкин И.Х., Иванов В.И.1996; Саакян Ю.М.,1996; J. D .Talley et al.,1988; Toraxcenter,1986; М. G Bouzassa, 1998) считают, что возврат стенокардии в отдаленном периоде зависит от степени реваскуляризации миокарда, но не зависит от клинической формы ИБС, при которой проводилась ТЛАП. A. Rodrigues et al.1995г., W. Weintraub et al. 1995г. выявили зависисмость возврата стенокардии от метода лечения ИБС. У пациентов, подвергшихся ТЛАП, частота возврата стенокардии выше, чем у больных с АКШ. И здесь следует учесть, что ангиопластику возможно повторять до тех пор, пока не достигнут ангиографический и клинический успех без ограничения во времени, чего нельзя сказать об АКШ. И результаты, полученные после повторных ТЛАП значительно лучше. Риск развития повторных ОИМ в отдаленном преиоде после ТЛАП выше у пациентов с многососудистым поражением коронарного русла и с неполной реваскуляризацией миокарда (Detre et al., 1988; Brien O. Murchu , 1993; Саакян Ю.М.,1996; Toraxcenter ,1986). Состояние коронарного русла и дилятированного сосуда в отдаленные сроки после ТЛАП. До настоящего времени нет четкого определения рестеноза после ТЛАП. Предложены различные диагностические критерии рестеноза, в частности, такие как: 1) уменьшение диаметра на 30% и более по сравнению с ее диаметром, достигнутым при ТЛАП; 2) наличие стеноза не менее 70% при стенозе непосредственно после ТЛАП менее 50%; 3) повышение выраженности стеноза более чем на 10% по сравнению с диаметром стеноза перед ТЛАП; 4) уменьшение на 50% и более диаметра просвета сосуда от достигнутого при ТЛАП; 5) уменьшение диаметра стеноза (меньшего 50% после ТЛАП) до 50% и более; 6) уменьшение минимального диаметра просвета сосуда на 0,7 мм по сравнению с просветом, достигнутым при ангиопластике (А.А Алексеевский, Д.В. Дроздов, А.Л. Сыркин, , A. E. Moreyra, A. Wajnberg, 1994). Частота рестенозов, по данным многочисленных исследователей, выполненные в различных учреждениях многих стран, колеблется в пределах 17−40 %. Как правило, рестеноз развивался в срок от 1−6 мес. после успешного проведения ТЛАП. В более ранние сроки возобновление коронарной недостаточности чаще обусловлено тромбозом дилятированного участка, а появление стенокардии в срок более 6 мес. обычно определяется поражение интактных или незначительных стенозированных на момент проведения ТЛАП участков артерии. Обращает на себя внимание, что примерно в 1/3 случаев рестеноз протекает без адекватной клинической симптоматики. По данным, R. Hernander et al., из 277 больных с рестенозом в сроки от 6 до 9 мес. у 48 % рестеноз не сопровождался клиникой стенокардии. В тоже время у 30−50% больных стенокардия не обусловлена развитием рестеноза. Эти наблюдения указывают на недостаточность учета только ангинозного синдрома для наблюдения за больным после ТЛАП. Патофизиологические механизмы рестеноза к настоящему времени недостаточно выяснены. Основным морфологическим субстратом рестеноза является фиброзно-мышечная гиперплазия интимы (Waller B.f. et al. 1987, Glagov S. 1994.,). Определенное значение принадлежит и формированию тромботических наслоений. Коронароангиоспазм также способствует ускорению фиброзно-мышечной гиперплазии. По мнению R. Schwartz et al. (1996) образование тромба на поверхности бляшки играет роль своеобразного матрикса, который облегчает пролиферацию гладкомышечных клеток. Каждый из описанных процессов занимает определенное время, таким образом, истинный рестеноз может сформироваться только к исходу 1−го месяца или позже после ТЛАП. В литературе рассматривается ряд факторов, повышающих риск развития рестеноза. Могут быть выделены клинические, морфологические и «технические» факторы. На частоту развития рестеноза оказывают влияние клиническое течение и характер ИБС, наличие отягчающих факторов риска. Существенны морфологические (ангиографические) характеристики стеноза: локализация, протяженность, выраженность, множественность поражения. К «техническим» факторам относятся все характерные особенности собственно процедуры ТЛАП и ее непосредственные результаты (Leimgruber P.P. et al. 1985, Bourassa M.G. et al. 1990,1991, Hermans W.R. et al., 1992.,). Цель многих исследований (Tohma H.,1991, Terres W. 1992, Garlek-A 1995) заключалась в изучении ангиографического и анатомического состояния коронарного русла в отдаленные сроки после эндоваскулярных лечебных процедур. Они определяли влияние таких факторов как курение, СД, ГБ, дислипопреидемия, объем поражения коронарного русла (поражение одной, двух или трех сосудов) на рестеноз и реокклюзию дилятированных сосудов. В ряде публикаций сообщается о повторной ангиопластике по поводу рестенозов, и авторы считают такую тактику закономерной и оправданной, считая рестеноз неизбежным последствием в определенном проценте случаев (В. Meier et al., 1984, Williams D. O. et al., 1984, O. Keefe et al., 1989). Ряд авторов (R .Muler, 1982, G. Austin, 1987, E. Fleck, 1988, Cregg J. Reis, 1991, Gurlek-A, 1995) считают, что пациенты с гиперлипидемией, многососудистым поражением, гипертонией имеют более высокий риск развития рестеноза. При этом отмечали, что пол, курение, предшествующие инфаркты миокарда не влияют на процесс рестенозирования. Другие авторы (Terres W., 1992г.), наоборот, выделяют женский пол, пожилой возраст, пациентов с сахарным диабетом в группе риска поздних осложнений и считают, что курение и гиперхолестеринемия не влияют на дальнейшее течение заболевания. Большинство авторов, Simonton C.A.1988; Starc C.,1988; Hiasa Y.,1994; O. Kamp et al. 1989; Inigues A., 1994., не выявили влияния клинических форм ИБС на развитие рестенозов в отдаленном периоде после ТЛАП. По наблюдениям Иоселиани Д.Г. с соавт., (1997), L. Mata (1985), P. P. Leimbrube et al. (1986), Sinisa M. Ketik (1995), Stone G. M. (1996) показали более вероятное появление реокклюзии при поражении ПМЖВ ЛКА с одновременной дисфункцией соответствующей области ЛЖ, приводящей к низкому кровотоку в дилятированном сосуде после ТЛАП. Эти пациенты склонны к развитию тромбоза и рестеноза. Остается мало изученным влияние таких факторов, как давление раздувания, время раздувания и количество раздуваний баллона на частоту рестенозов. B. Meier et al. (1984) отметили высокий процент непосредственного успеха при использование высокого давления в баллоне в момент дилятации. Однако снижение частоты рестенозов не было статистически достоверным. Meier B. 1989г, Hermans W. R. 1992г., Banka V.S. et al. 1993г. предлагают использовать продолжительное раздувание с постепенным повышением давления в баллоне. По их мнению, это способствует постепенному ремоделированию сосуда без глубоких повреждений его стенки и приводит к снижению частоты рестеноза. R. Uebis 1989г. сравнил частоту рестенозов в группе с однократной дилятацией (14,7%) и в группе с 3−х кратной дилятацией (34%). Roubin G.S et al. (1987) сообщает, что при многократном раздувании баллона наблюдается высокая частота рестенозов (53%) по сравнению с меньшим количеством раздуваний (26%). C.J. Botman (1989) считает, что выбор баллона большего размера для повторных процедур ТЛАП снижает показатели рестеноза с 60% до 25%. Изучив состояние коронарного русла в отдаленном периоде после ТЛАП, авторы подняли вопрос о повторных процедурах, в которых нуждается пациент после баллонной ангиопластики при прогрессировании атеросклероза, появлении клиники стенокардии и выявлении на КАГ рестенозов или реокклюзий. Практически все исследователи (A. Rodrigues et al. 1995г., J-J Goy et al. 1995г., K. Detre et al. 1986г, J. D. Talley 1988г, E. Berger et al. 1986г., G. Kober et al. 1989г., W. M. Muller 1990г, H. Bonnier et al. 1989г., P.Guiteras 1990г.) пришли к мнению, что пациенты подвергшиеся ТЛАП, нуждаются в повторных процедурах реваскуляризации в отдаленном периоде. Таким образом, развитие рестеноза и реокклюзии в отдаленные сроки после ТЛАП является неизбежным процессом в определенном проценте случаев и проведение дополнительных процедур (повторная ТЛАП, стентирование и АКШ) являются в ряде случаев неотъемлемой частью лечения. Влияние многих факторов риска (возраст, пол, курение, гиперхолестеринемия, СД, ГБ, характер поражения, локализация поражения) на развитие рестеноза остается спорным и изученным недостаточно полно.
Влияние ТЛАП на сократительную функцию миокарда ЛЖ. Сократительная функция ЛЖ является одним из наиболее важных предикторов «качества» и продолжительности жизни пациентов с разными формами ИБС, (Sanz G. 1982, De Feyter P. J. 1982, Kander N. H. 1989). В настоящее время остается открытым вопрос о влиянии баллонной ангиопластики на сократительную функцию ЛЖ у больных ИБС. T. Linderer et al. (1992) сообщил, что ТЛАП, проведенная как при стабильной, так и при нестабильной стенокардии, нормализует сниженную функцию ЛЖ. Так как сократительная функция ЛЖ резко изменяется при ОИМ, то наибольшему изучению подверглись больные, которым проводилась ТЛАП в острую стадию инфаркта миокарда. Главный механизм, которым тромболитическая терапия улучшает отдаленную выживаемость, является сохранение функции ЛЖ за счет раннего восстановления и сохранения проходимости ИЗКА (Stadius M.L. 1986, Sheehan F.H.1988, Feifenbrumm A.J.1992, Brodie B.R. 1996). Согласно данным Эль Хатиб Мохаммед 1994г., Иоселиани Д.Г. 1996г., D. Rothbaum 1989г., Fiefenbrumm A.J. 1992г., наиболее ранняя реперфузия ИЗКА способствует максимальному спасению ишемизированного миокарда, уменьшению дилятации ЛЖ и более низкой смертности. При этом Voqt A. (1988) считает, что только восстановление кровотока в полном объеме в ИЗКА приводит к улучшению функции ЛЖ и выживаемости в отдаленные сроки. Особого внимания заслуживает тот факт, что рестенозирование практически не влияет отрицательно на клиническое течение заболевания и на процесс восстановления функции ЛЖ (Савченко А.П. 1991, Crhistophe Bauters 1995). Возможным объяснением может служить функциональная адаптация системы коронарного кровоснабжения, которая успевает реализоваться при постепенном рестенозировании ИЗКА. Sheehan F.H.1988г., Feifebrumm A.J. 1992г., Leunq W. H. 1992г. считают, что резидуальный стеноз ИЗКА сопровождается дилятацией ЛЖ, препятствует улучшению ОФВ ЛЖ. При этом степень дилятации ЛЖ определяется степенью резидуального стеноза ИЗКА при выписке из стационара (Dalen J.E. 1986, Stadius M.L.1986). James H. O’Keefe (1992) считает, что уже на госпитальном этапе сегментарная фракция выброса в зоне инфаркта увеличивается на 30% и наиболее значимо возрастает у больных с исходным показателем ОФВ ЛЖ< 40% (в среднем от 28% до 42%). Однако вопрос о сроке выполнения реперфузии ИЗКА, в пределах которого эта процедура может быть еще эффективной, остается спорным. Существует мнение, что ТЛАП, выполняемая даже спустя 48 часов после начала ангинозного приступа, улучшает клинический исход, но не улучшает функцию ЛЖ (Ellis S.G. 1989). S. Miketik et al. (1995) считает, что успешное восстановление оптимальной перфузии в поздние сроки (2−8 недель) у пациентов с сохраняющейся ишемией после ОИМ может улучшить ОФВ ЛЖ за счет улучшения сегментарной функции стенки ЛЖ в зоне инфаркта, а не за счет компенсаторной гиперкинезии неинфарктной зоны. Garot G. et al. (1996) отмечает достоверное увеличение ОФВ ЛЖ на отдаленном этапе после ТЛАП ИЗКА спустя 3−4 недели после развития ОИМ и при этом указывает на обратное развитие аневризмы в случае сохранения открытого состояния ИЗКА. Иоселиани Д.Г. с соавт., (1997) показали, что независимо от способа проводимого лечения (ТЛАП или консервативное лечение) при контрольном обследование через 12+1,4 мес. функция ЛЖ улучшалась. При этом более значительное улучшение отмечалось в группе с успешной реперфузией. Положительная динамика при этом зависела от количества пораженных артерий: при однососудистом поражении ОФВ ЛЖ увеличивалась на 9,4+3,2%, а при многососудистом на 5,5+2,4 %. В группе с выявленной реокклюзией и рестенозом ОФВ ЛЖ практически не изменилась. В незначительном проценте случаев (преимущественно у пациентов с нестабильной стенокардии и повторным ОИМ) отмечалось снижение ОФВ ЛЖ. Таким образом, из всего выше сказанного можно сделать вывод, что вопросы о влиянии ТЛАП на сократительную функцию ЛЖ у больных со стабильной и нестабильной стенокардией, а также при остром инфаркте миокарда остается спорным. Дискутируется также вопрос о сроках выполнения реперфузии ИЗКА, когда эта процедура может быть еще эффективной.
Выводы: На основании данных литературы установлено, что ТЛАП коронарных артерий является высокоэффективным, наиболее безопасным и экономичным методом лечения больных с разными формами ИБС. По данным современных исследователей, имеются противоречивые сведения о выживаемости больных после ТЛАП при одно и многососудистом поражении коронарных артерий, при низкой и нормальной сократительной функции ЛЖ. Расходится мнение исследователей о значении факторов риска на развитие рестеноза в отдаленном периоде после ТЛАП. Остается спорным вопрос об эффективности баллонной ангиопластики, ее влияние на различные аспекты качества жизни больных в отдаленном периоде, предупреждение повторных ОИМ, о необходимости проведения повторных процедур в отдаленном периоде. Дискутируется вопрос о применении ТЛАП у больных с множественным поражением коронарного русла.
Список литературы. 1. Аnderson H.V. Restenosis after coronary angioplasty. Dis Mon.1993; 39: 613−670. 2. Bates E. Bell D.E.Grill et. al. Long- Term outcome of women Compared with men after Succesfull Coronary angioplasty. Circulation. 1995; 91:2876−2881. 3. Bentivoglio L.G., Holubkov R., Kelsey S. F. et al. Short and long term outcome of percutaneous transluminal coronary angioplasty in unstable versus stable angina pectoris a report of the 1985−1986 NHLBI PTCA registry. Cathet Cardiovasc Diag. 1991; 23: 227−38. 4. Berger, M. R. Bell et. al. Effect of restenosis after an Earlier Angioplasty at another coronary site on the Freguency of Restenosis after a subseguent coronary angioplasty. Am. J. Cardiol.1992; 69:1086−1088. 5. H. Bonnier, P. Bronzwaer., R. Michels and M. El. Gamal. Long term follow up of 100 patients with left anterior descending artery lesions treated with Percutaneous Transluminal coronary angioplasty. European Heart Journal. 1989; 10: 49−51. 6. C.J. Botman., M. El. Gamal., F.El. Deeb. et. al. Percutaneous transluminal coronary angioplasty more than twice for the same coronary lesson. Europen Heart J.1989; 10: 112−116. 7. Bourassa M.G., Feldman B., Brower R.W. Strategy for complete revascularizatuion in patients with multivessel coronary disease. Am. J. Cardiology.1992; 70: 2:174−178. 8. Brodie B.R. Grines C.L. Ivanchoe R. Six -month clinical and angigraphic follow up after direct angioplasty for acute myocardial infarction. Final results from Primary Angioplasty Registry . Circulation. 1994; 90(1). 9. Mc. Bride W., Lange R. A., Hillis L.D. Restenosis after succesful coronary angioplasty. N. Engl. J. Med. 1988; 318:1734−7. 10. Dangoisse V., Guiteras P., David P.R., Lesperanse J. et al. Reccurens of stenosis after succesful percutaneous transluminal coronary anqioplasty. Circulation.1982; 66: 2−331. 11. De Feyter P.J.Coronary angioplasty for unstable angina . Am.Heart J. 1989; 860. 12. De Feyter H.J.PTCA in patients with stable angina pectoris and multivessel disease: is incomplete revascularization acceptable? Clin. Cardiol.1992;15: 317−322. 13. K. Detre., R. Holubkov, Sh. Kelsey et. al. One—year follow up results of the 1985 -1986 National Heart, Lung and Blood Inst. PTCA Registry. N engl J Med. 1988; 318:265−270. 14. Galan K. M., Deligonul U., Kern M. J., Chaitman B. R. et al. Incresed frequensy of restenosis in patients continuing to smokt cigarettes after percutaneous transluminal coronary angioplasty.Am. J. Cardiol. 1988; 61: 260−263. 15. Gruintzig A.R., King S.B. 3, Schlumpf M., Siegenthaler W. Long-termfollow-up after PTCA : the early experience. // N Engl. J. Med.- 1987.-Vol.316.-P.1127−1132. 16. Guiteras.V.P., Bourassa M.G., David Р.R., Bonan R , Grepeau J. et al. Restenosis after succesful percutaneous transluminal coronary angioplasty. The Montreal Heart Institute experience. Am.J.Cardiol. 1987; 60: 50B –55B. 17. P.Guiteras., L.Tomas., C. Varas and et.al. Five years of angiographic and clinical coronary angioplasty. European Heart J. 1989; 10: 42−48. 18. Harts A.G., Mabin T.A., Holmes D.R. Mortality after PTCA and coronary bypass surgery.Am. J. Cardiol.1992; 70:179−185. 19. Hiasa Y., Furinaga H., Wada T. Restenosis after successfull emergency coronary angioplasty for acute miocardial infarction Comparison with elective angioplasty. Int-J-Cardiol.1994; 47: 49−54. 20. Yolmes D.R., Holubkov R., Vlietstra R.E. et al. Comparison of complications during PTCA from 1977 to 1981 and from 1985 to 1986. J. Am.Coll Cardiol. 1988; 12: 1149−1155. 21. Kadel C., Vallbracht C., Buss F., Kober G., Kaltenbach M. Long- term follow up after percutaneous transluminal coronary angioplasty in patiens with singl-vessel disease. Am. Heart J. 1992; 124: 1159−69. 22. Kamp O., Beatt K.J., De Feyter P. Short, medium and lonq term follow up after PTCA for stable and unstable angina pectoris. Am. Heart J. 1989:117: 1:991−996. 23. Kander N.H., O Neil W., Topol E. J. et al. Long-Term follow up of patients hearted with PTCA for acute myocardial infarction. Am. Heart J. 1989; 118:2: 228−233. 24. Kent K.M., Bentivoglio L.G.,Block P.C., Bourassa M.G. et al. Long-term efficacy of PTCA : Report from the NHLBI PTCA Registry. Am. J. Cardiol. 1984; 53: 27C−31C. 25. Kohli R.S., DiSciascio G., Cowley M.J., Nath A., King S. B. 3 et al. Coronary angioplasty in patients with severy left ventricular disfunctions. J.Am/Cardiol.1990;16:807−811. 26. Leimgruber P.P., Roubin G.S., Hollman J., Cotsonis G.A., Meier B. et al. Restenosis after succesful coronary angioplasty in patients with single vessel disease. Circulations.1986; 73: 710−717. 27. Meyer J., Bocker B., Erbel R. et al. Treatment of unstable angina with PTCA. Circulation.1990; 60:3−160. 28. David W.M. Muller, Eric J. Topol, Barry S. George et. al. Two-year outcome after angiographically Documented Miocardial Reperfusion for Acute Coronary occlusion . Am. J. Cardiol 1990; 60; 796−801. 29. Myler R.K.,Topol E.J., Shaw r.e., Stertzer S.N. et al. Multiple vessel coronary angioplasty: classification, results and patterns of restenosis in 494 consesutive patiens. Cathet & Cardiovascular Diagn.1987;13: 1−15. 30. RITA Trial Participants Coronary angioplasty versus coronary artery bypass surgery the Randomized Intervention Treatment of Angina (RITA) trial. Lancet 1993; 341: 573−80. 31. Roubin G.S., Douglas J.S., King S.B.3 et al. Influence of balloon size on initial succes, acute complication and restenosis after PTCA. Circulation.1988; 78: 916−927. 32. Sabri, G. Di Siascio, M.J. Cowley et. al. Immediate and Lonq Term Result of Pelayed Recanalization of occluded Acute Miocardial infarction- Related arteries using Coronary angioplasty.Am.J. Cardiol. 1992; 69; 575−578. 33. Talley, J.W. Hurst, S. B, King 3 et. al. Clinical outcome 5 years after attempted PTCA in 427 patients. Circulation. 1988;77:4: 820. 34. Vandormael M.G., Deligonul U., Kern M.J. et al. Multilesion coronary anqioplasty: Clinical and angigraphic follow-up. J.Am.Coll Cardiol. 1987; 10: 246−252. 35. W.S.Weintraub., A.S. Kosinski Brown C.L. et al. Can restenosis after coronary angioplasty be predicted from clinical variables? J. Am. Coll Cardiol.1993; 21: 6−14.
Ангиопластика сосудов нижних конечностей
Ангиопластика сосудов нижних конечностей показана при выраженных клинических проявлениях ишемии, а также язвенно – некротических изменениях нижних конечностей. Выбор оперативного вмешательства в пользу чрескожного вмешательства зависит от типа стенозирования и его протяженности. Отмечается высокий непосредственный успех ангиопластики – около 90%, с сохранением проходимости сосуда после 5 лет наблюдения около 80 %.
ангиопластика сосудов нижних конечностей
Методика транслюминального введения
Местом доступа выбирают обычно артерию бедра. Длина разреза не превышает 2 мм, через него продвигают трокар по сосуду. По этой трубке вводится контраст для визуализации участка сужения. На мониторе выявляется локализация стеноза, к ней подводится проволока, определяющая, где лучше разрушить бляшку.
После этого катетер проходит к нужной зоне, в баллончик накачивают физиологический раствор для восстановления проходимости сосуда и разрушения бляшки. Затем проводится контрольное исследование и извлечение катетера и проволоки. Заключительным этапом является наложение повязки и наблюдение на протяжении суток для предотвращения послеоперационных осложнений.
Если чрескожную транслюминарную пластику артерии совмещают с установкой стента, то, при раздувании баллоном, эту металлическую конструкцию расправляют внутри просвета сосуда. Стент также может быть и саморасправляющимся, тогда этапа баллонного расширения не будет. Материал стента может иметь покрытие для предотвращения повторной закупорки.
Выполненная ангиопластика
Весь период манипуляций занимает около 2 часов. В это время бывают неприятные ощущения, связанные с расширением артерии в виде боли или жжения в грудной клетке.
Преимущества ангиопластики по сравнению с традиционной хирургией
- Минимальная физическая и психическая травма для больного. Операция выполняется без разреза, под местной анестезией и практически безболезненна.
- Сокращается до одного – двух дней время нахождения в больнице. Больной быстро возвращается к обычному образу жизни после выписки.
- Высокая эффективность эндоваскулярных вмешательств.
- Процедуру можно выполнять пациентам с тяжелыми заболеваниями, когда традиционные хирургические операции невыполнимы.
- Противопоказания незначительны: выраженная аллергия на контрастные препараты, нарушения свертываемости крови, острая почечная недостаточность.
- Более низкая стоимость по сравнению с открытыми операциями.
Что делать после ангиопластики
После операции пациента переводят в палату и 24 часа он находится под контролем ЭКГ аппаратуры. Медицинский персонал обеспечивает постоянный мониторинг состояния больного, динамику показателей крови и место прокола.
Чтобы вывести из организма контрастное вещество, пациент должен выпивать достаточное количество жидкости.
После выписки из больницы противопоказаны любые нагрузки. Больной должен самостоятельно следить за проколом. При первых признаках кровотечения из артерии надо зажать кровоточащее место и в срочном порядке вызвать бригаду скорой помощи.
После оперативного вмешательства пациенту должны быть предписаны лекарственные препараты, которые предупреждают образование тромбов.
Как правильно выбрать лечебное учреждение для проведения ангиопластики?
Основное требование при выборе лечебного учреждения – это количество выполняемых в клинике чрескожных вмешательств на сосудах и наличие специализированного хирургического отделения для возможного проведения расширенной операции на сосудах, в случае возникновения осложнений в ходе выполнения ангиопластики.
Выработаны четкие рекомендации по выбору клиники для проведения чрескожных вмешательств на коронарных сосудах – не менее 400 вмешательств в год, а также наличие в клинике кардиохирургического отделения.
Вопросы, которые надо задать врачу
- Детально обсудить с врачом риск и пользу чрескожного вмешательства по сравнению с традиционной хирургией и медикаментозной терапией. Важно быть уверенным, что Вы консультируетесь с высококвалифицированным специалистом, имеющим большой опыт чрескожных вмешательств. Так как только врач принимает решение по всем вопросам, касающимся Вашего лечения.
- Определиться с выбором стента. Стенты, выделяющие лекарства значительно дороже простых металлических стентов. Доказано их преимущество для уменьшения количества рестенозов после коронарной ангиопластики со стентированием.
Нет ни одного исследования, продемонстрировавшего преимущество одного вида стентов перед другими (с покрытием или обычные металлические) в плане уменьшения количества неврологических осложнений при ангиопластике со стентированием сонных артерий.
Следует помнить, что стенты, выделяющие лекарства потребуют длительного приема серьезной антитромбоцитарной терапии:
- Решите для себя, сможете ли Вы четко выполнять все рекомендации по приему антитромбоцитарной терапии и оцените свои финансовые возможности;
- Если Вы планируете какие – либо инвазивные процедуры или хирургические вмешательства в ближайшие 12 месяцев, что потребует отмены приема антитромбоцитарных препаратов из – за риска кровотечения, предпочтение следует отдать имплантации стандартного металлического стента.
Это необходимо принимать во внимание, так как прерывание антитромбоцитарной терапии после чрескожного вмешательства на коронарных артериях является независимым фактором риска развития тромбоза – закпорки стента сгустком крови.
Если врач настаивает на использовании стента, выделяющего лекарства в связи с особенностями атеросклеротического поражения сосуда или сопутствующими заболеваниями, то к этому надо прислушаться. Однако выбор остается за Вами.
Оборудование для чрескожного вмешательства
Хотя это метод и малоинвазивный, так как нет открытой операционной раны, но его проводят исключительно в специальных операционных. Требуется такой минимальный набор диагностических приборов и расходных материалов:
- рентгеновский аппарат с монитором для визуализации хода операции;
- баллонный катетер – трубка достаточной длины для прохождения пораженного сосуда, на ее конце есть баллончик, который заполняют физиологическим раствором для расширения;
- проводник – гибкий провод, направляющий катетер к цели;
- стент – металлический каркас для постановки в зону сужения, до введения это сжатая трубочка, ее раздувает баллончик до нужного размера;
- троакар – трубочка для введения катетера в артерию.
Жизнь после стентирования
Важно помнить, что чрескожное вмешательство – это устранение последствий болезни, а не самой болезни.
С целью предотвращения прогрессирования атеросклероза и развития тромбообразования:
- Четко следуйте рекомендациям врача по приему антитромбоцитарных препаратов в течение первых 3-х месяцев – года после стентирования. Выбор схемы антиагрегантного лечения индивидуален для каждого пациента.
- Соблюдайте гиполипидемическую диету, принимайте холестеринснижающие препараты для уменьшения холестерина липопротеинов низкой плотности ниже 100 мг/дл.
- Регулярно контролируйте уровень артериального давления. Снижения артериального давления рекомендуется достигать путем изменения образа жизни и назначения индивидуального медикаментозного лечения. Особое внимание должно быть уделено ограничению потребления повареной соли.
- Устранение факторов риска прогрессирования атеросклероза: снижение избыточной массы тела, путем снижения калорийности пищи, отказ от курения и злоупотребления алкоголем, дозированные физические тренировки.
Риски ангиопластики
- В очень редких случаях всё же возможно появление аллергической реакции на рентгеноконтрастное вещество или местное обезболивание.
- Иногда артерии может повредить проводник, тогда может понадобиться срочное открытое хирургическое вмешательство.
- Есть риск возникновения инсульта.
- В месте пункции сосуда может развиться гематома.
- Возможно смещение атеросклеротической бляшки.
У ангиопластики, как и любой процедуры могут возникнуть свои осложнения. Чтобы получить информацию о сути производимого процесса и возможных неприятных его последствиях, следует проконсультироваться у врача.
Стоимость процедуры ангиопластики со стентированием
Стоимость процедуры будет зависеть от того, в какой клинике и в какой стране будет производиться операция, от степени и сложности поражения и конкретной артерии, количества стенозированных сосудов, технических особенностей процедуры. Но основная составляющая цены – это стоимость стента.
Стоимость процедуры ангиопластики в России колеблется от 80 000 рублей до 180000 рублей. Сюда входит манипуляция, пребывание в стационаре, медикаменты и питание. Стоимость самих стентов колеблется от 40000 до 130000 рублей.
Коронарное стентирование пациентам с острым инфарктом миокарда или нестабильной стенокардией доставляемым в клинику бригадами скорой помощи в экстренном порядке проводится бесплатно по полису обязательного медицинского страхования.
Ангиопластика со стентированием при ишемической болезни сердца со стенозом 1-3-х коронарных артерий включена в базовую программу обязательного медицинского страхования и может быть оказана бесплатно.
Прогноз после лечения
Коронарная ангиопластика значительно увеличивает поток крови через ранее суженную или закупоренную коронарную артерию. При этом боль в груди (стенокардия) обычно должна уменьшится, а физические возможности организма наоборот должны возрастать.
Нужно понимать, что ангиопластика и стентирование не излечивает ишемическую болезнь сердца, а лишь устраняет конкретные нарушения кровобращения сердечной мышцы. Для достижения стабильного результата необходимо вести здоровый образ жизни и принимать лекарства, предписанные врачом.
Если симптомы стенокардии возвращаются, то необходимо еще раз обратиться к своему врачу, а если появились боли в груди в покое, которые не реагируют на нитроглицерин, то вызывайте скорую помощь.
После коронарной ангиопластики и стентирования качество жизни улучшается у 95% пациентов, при этом у многих из них эффект сохраняется более 5 лет.
Отзывы пациентов
Отзывы людей, перенесших стентирование, в основном положительные и описывают ощущения, которые они испытывали до, во время и после операции.
Многие отмечают безболезненность операции и значительное улучшение самочувствия практически сразу после вмешательства. Все пишут о необходимости постоянно принимать лекарства, наблюдаться у врача, контролировать некоторые параметры свертываемости крови.
Кое-кто изменил после операции свой образ жизни: решил отказаться от курения, сбросил лишний вес, начал вести активный образ жизни.
Пишут также, что необходимо всё-таки своевременно решаться на операцию, не затягивать болезнь и иметь положительный настрой на выздоровление. А также, что важна поддержка близких и родных людей.
Подготовка к ангиопластике
- Лечащий врач должен определить список лекарств, которые необходимо принимать перед операцией. Среди них должны быть препараты, которые не дадут при процедуре образовываться тромбам.
- Нужно продумать способ возвращения домой после вмешательства.
- Необходимо проинформировать врача об имеющихся проблемах с почками или аллергии на продукты, содержащие йод, например, морепродукты, а также на рентгеноконтрастные вещества.
- Перед процедурой потребуется подписать согласие, как на саму ангиопластику, так и на рентгеновское исследование сосудов при помощи рентгеноконтрастного вещества – ангиографию (коронографию).
- Минимум 4 часа перед операцией нельзя пить и есть.
- Нужно сдать предварительные анализы крови, сделать ЭКГ и согласно показаниям сделать прочие исследования.
- Накануне операции следует выбрить и помыть область пункции (пах, запястье или локтевую зону) во избежание инфицирования.
Как подготовиться
Подготовка к операции заключается в следующем:
- Больной проходит ряд обязательных исследований: ЭКГ, общий анализ крови, биохимический состав, ультразвуковая диагностика и рентгенография. Преаналитический этап важен для подтверждения степени патологического процесса и четкого места определения сужения. В некоторых клиниках требуют консультации офтальмолога и эндокринолога.
- После пациента укладывают в стационар, где повторно собирают анамнез и восстанавливают клиническую картину заболевания. Врачи повторно проводят рентгенографию, но же в нескольких проекциях, для точного определения малоинвазивного вмешательства.
- Назначается ангиография или дуплексное сканирование вен и артерий. После получения основных и вспомогательных данных о состоянии пациента, назначается день выполнения операции.
- В день хирургического вмешательства не следует кушать за 2 дня – необходимо отказаться от приема лекарственных средств и алкоголя. Если пациент не может отметить прием медикаментов, то он должен сообщить врачу об этом факте.