Заболевания кардиальных структур у детей встречаются в 3-5% случаев от общей популяции младшего возраста. Диагнозы неодинаково опасны, чтобы сказать что-то конкретное требуется проведение тщательной всесторонней диагностики.
Шум в сердце у ребенка — это патологический звук, который обнаруживается в ходе аускультации между функциональными моментами: систолами (сокращениями сердца) и диастолами (расслаблением мышечного органа).
Не всегда речь идет о заболевании. У взрослых изменения, зафиксированные в ходе аускультации (выслушивания) однозначно имеют аномальную природу.
Шумы в сердце в раннем возрасте требуют дополнительной инструментальной диагностики, чтобы выявить их генез. Как минимум, проводится ЭКГ, эхокардиография.
Клиническая картина, если он и присутствует, то неспецифична, говорит о том или ином отклонении.
Терапия консервативная при нарушениях, не сопряженных с анатомическими изменениями, оперативная в рамках лечения врожденных или приобретенных в ранние годы пороков.
Виды шумов
Классификация проводится по двум ключевым основаниям. Первое — по типу отклонения от условной нормы.
Соответственно выделяют:
- Функциональные шумы (физиологические, ФСШ сокращенно). Если у взрослых объективный симптом всегда указывает на аномалии, дефекты, в детский период это не аксиома, а в 97% вариант нормы.
Более того, примерно в половине случаев, а то и свыше, у молодых пациентов обнаруживаются посторонние звуки при аускультации.
В 1, 2 и 3 год жизни причина кроется в перестройке сердечнососудистой системы, адаптации к существованию вне утробы матери.
С 4 года обнаруживается связь с взрослением, ростом организма, а затем с пубертатом. Условно детство заканчивается к началу полового созревания, то есть к 12-13 годам, тогда и шумы исчезают.
ФСШ у ребенка — не диагноз, а функциональный шум сердца, звук слышимый во время аускультации.
- Патологические шумы (органические). На их долю приходится другая половина зафиксированных ситуаций.
Возникают в результате воздействия множества факторов. В том числе пороков, врожденных и приобретенных.
Отграничить состояния «на глаз» не выйдет. Требуется инструментальная диагностика. Предположить наличие проблемы можно по симптомам.
Внимание:
В рамках функциональных шумов нет никакой клинической картины (симптомов). Ее может и не быть при заболевании, потому это не надежный дифференциальный критерий.
Возможно подразделение по другому основанию. Он касается момента возникновения аномального звука. Тогда говорят еще паре нарушения.
Выделяют два нормальных тона сердца:
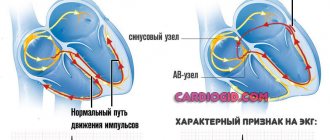
- Первый — систолический. Возникает при сокращении кардиальных структур, закрытии атриовентрикулярных клапанов. В норме после него и до момента расслабления нет никаких симптомов при аускультации.
Шумы чаще всего говорят о пороках, вроде пролапса митрального, аортального, клапанов, их дефектах и прочих явлениях.
- Второй тон — диастолический. Обнаруживается уже после выталкивания крови в большой круг, при возвращении ее в легочную артерию.
Нарушения на аускультации в таком случае выявляются в по причине функциональных расстройств (в аномальном смысле). Например, в рамках перенесенного воспаления миокарда и прочих моментов.
В некоторых случаях обнаруживается нарушение сразу всех тонов, тогда шум фиксируется дважды за один полный сократительный цикл сердца.
Классификации широко используются врачами в рамках первичного обследования, разработки тактики терапии.
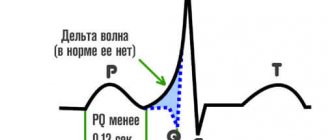
Систолический шум в сердце у ребенка более показателен. Но и он не дает однозначного ответа на вопросы «что это» и «почему возникло». Точку ставит электрокардиография, ЭХО-КГ.
При необходимости дополнительные методы, вроде МРТ, рентгена.
Шум сердца
Одним из частых признаков поражения сердца являются шумы сердца. Сердечные шумы на сегодняшний день регистрируются у более половины всех рождающихся детей. Бытует мнение, что у всех детей в каком-то периоде роста имеется шум в сердце, но причины его различны. И хотя в большинстве случаев шум не свидетельствует о наличии органической патологии сердца, относиться к нему нужно с большим вниманием. Таких детей подвергают дополнительным обследованиям и наблюдают у кардиолога.
Шумы подразделяются на систолические и диастолические. По происхождению они могут быть органическими и функциональными. Первые характерны для аномалии в развитии сердца, причины возникновения функциональных шумов может быть различна. Традиционно считается, что систолический шум больше характерен для функциональной его природы. Диастолические шумы у детей в большинстве случаев имеют органический генез (причину) и возникают при недостаточности клапанов аорты и легочной артерии; стенозе левого и правого атриовентрикулярных отверстий; патологическом сбросе крови в диастолу: дефекте аортолегочной перегородки, открытом аортальном протоке и т.д.
Различаются шум и по громкости, продолжительности, тембру, зоне максимальной локализации и области преимущественного проведения.
Для наглядности данные о характеристиках и причинах функциональных шумов у детей и подростков можно отобразить в таблице:
| Шум | Примерный возраст | Временная характеристика | Происхождение |
| Шум периферического стеноза легочной артерии | Новорожденный | Систолический шум изгнания | Бифуркация легочной артерии |
| Вибрирующий шум Стилла | 3–8 лет | Систолический шум изгнания | Неизвестно |
| Каротидный шум | 3–8 лет | Систолический шум изгнания | Сонные артерии |
| Венозный шум – «шум волчка» | 3–8 лет | Непрерывный | Яремная и верхняя полая вена |
| Шум легочного кровотока | 6–18 лет | Систолический шум изгнания | Клапан легочной артерии |
Но немногим родителям известно, что шум может сопровождать небольшие структурные отклонения в развитии сердца, не оказывающие существенного влияния на его работу, или отражать значительные нарушения кровотока, связанные с врожденным пороком сердца.
С введением в широкую практику ультразвукового исследования сердца (эхокардиографии) стало ясно, что для возникновения шума обязательно необходима какая-либо анатомическая причина, то есть они почти все «органические». Поэтому в настоящее время считается более правильным разделять шумы на «невинные» и «патологические».
Родителям нужно знать: функциональные шумы могут встречаться и у практически здоровых детей в различные возрастные периоды.
Реклама
Причины патологических шумов
Можно назвать врожденные и приобретенные заболевания, провоцирующие аномальные результаты аускультации. Первые представлены отклонениями тканевого характера.
- Недостаточность митрального клапана. Провоцирует регургитацию, то есть ток крови из левого желудочка обратно в предсердие. Чего быть, конечно же, в норме не должно.
Порок провоцирует недостаточную трофику (питание) всех тканей человеческого тела. Скудное количество выбрасывается в аорту и доходит до систем.
Страдают головной мозг, печень, почки, само сердце, пищеварительный тракт. Грозные гемодинамические отклонения, а потом и осложнения развиваются не в один момент.
Обычно требуется несколько лет на прогрессирование, но возможны варианты.
- Недостаточность аортального, трикуспидального клапанов. Провоцирует расстройства нормального тока крови, питания всех органов и систем. Механизмы связаны с неправильной циркуляцией жидкой ткани по телу.
- Пороки межпредсердной перегородки.
Указанные отклонения от нормы имеют генетическое происхождение в 40% случаев или чуть более. То есть основу этиологии составляет мутация.
Таковая развивается в ранние периоды, в начале первого триместра, когда сердце и сосуды только еще закладываются.
Изолированно расстройства работы мышечного органа практически не встречаются. Много чаще речь идет о системных хромосомных отклонениях. Классический пример — синдром Дауна. И таких можно насчитать много более.
Другой вероятный вариант — спонтанные нарушения внутриутробного развития. Причина обычно кроется в перенесенных матерью болезнях либо негативных факторах, влияющих на плод в течение гестационного периода. Например, никотин (курения), алкоголь, наркотические вещества.
Сказывается бесконтрольный прием препаратов, особенно гормонального плана, популярны средства на основе синтетического прогестерона, которые матери самовольно принимают, не задумываясь о последствиях.
Высокий радиационный фон, неправильное питание с избытком вредных веществ (например, солей азотистых кислот — нитратов). Эти факторы нужно учитывать при вынашивании, чтобы снизить риски до минимума.
Приобретенные заболевания многочисленные. Но у детей они все же встречаются сравнительно редко.
- Ревматизм. Аутоиммунная патология. Сопровождается регулярным рецидивирующим воспалением кардиальных структур, миокарда.
Полностью лечению не поддается, потому суть терапии заключается в предотвращении обострений и купировании симптомов с помощью глюкокортикоидов и иммуносупрессоров.
- Инфекционные процессы. Встречаются относительно в малом числе случаев. Представлены воспалением самого миокарда (миокардит), околосердечной сумки, прочих структур. Возможны сочетанные процессы.
Вне основного источника бактериального поражения отклонение почти не встречается. Потому во всех ситуациях обнаруживаются сторонние расстройства: ангины, кариес, хронический тонзиллит, ларингит, фарингит и прочие варианты, также артриты инфекционного генеза.
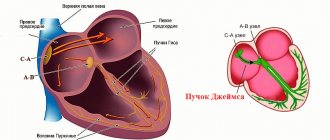
Перечень неполный. Возможны и иные отклонения, в том числе коллагенозы, разрастание соединительной ткани, нарушения проводимости особых структур сердца (пучок Гиса), аритмии, но это, скорее, следствие.
Потому, как и сами эти заболевания спонтанно не возникают. Фактор происхождения нужно искать выше.
- Крайне редко виновником выступает инфаркт. У детей развитие столь грозного состояния — чистая казуистика, случайность.
- Такой же нечастый «гость» — травмы грудной клетки с повреждением сердца. Ребра хорошо защищают внутренние органы, к тому же интенсивность воздействия должна быть крайне велика.
Классический вариант — дорожно-транспортное происшествие с переломом грудины, тяжелыми ушибами. Аномальные звуки обнаруживаются уже после проведенного лечения.
- Причины шумов в сердце у ребенка встречаются и в результате ятрогенного (врачебного) фактора. Как пример, после проведенного оперативного лечения эндоваскулярным или классическим открытым доступом, обследования на предмет прочих патологий (предполагает катетеризацию, проникновение в сосудистое русло и сердце).
Косвенно аномальные звуки могут обуславливаться гипертонической болезнью, изменениями со стороны сосудов в результате васкулита (воспаления внутренней выстилки артерий), атеросклероза (обнаруживается в 0.7-1.2% случаев, обычно на фоне обменных нарушений, болезни Иценко-Кушинга).
Факторы многообразны и не всегда очевидны. Имеет смысл тщательно обследовать молодого пациента.
Причины возникновения шумов в сердце у детей
Шум в сердце детей чаще всего связан с некоторыми состояниями организма и отклонениями в развитии. Условно причины можно разделить на несколько групп:
- Отклонения в развитии клапанов сердца:
- стеноз митрального клапана и аортального (анатомическое его сужение);
- регургитация вышеописанных клапанов (обратное забрасывание крови);
- недостаточность или стеноз трикуспидального (трехстворчатого) клапана;
- стеноз легочной артерии.
- Наличие аномальных отверстий:
- открытый артериальный проток (наличие дополнительного сосуда, соединяющего легочную артерию и аорту);
- наличие патологических отверстий между камерами: ДМПП (дефект межпредсердной перегородки) и ДМЖП (дефект межжелудочковой перегородки).
- Патология миокарда (мышцы сердца):
- врожденные изменения – гипертрофическая кардиомиопатия;
- приобретенные пороки. Редко встречаются в детском возрасте. К ним относятся инфаркт миокарда, сердечная недостаточность.
- Иные приобретенные и наследственные заболевания:
- эндокардиты – воспаления оболочки сердца, формирующей клапаны;
- тетрада Фалло – сложный комбинированный сердечный порок, сочетающий в себе поражение и сердечной мышцы и клапанного аппарата;
- дополнительная хорда, находящаяся в левом желудочке;
- коарктация аорты – сужение ее просвета. Чаще всего сосуд поражен сегментарно;
- миксома сердца – опухоль (доброкачественная), располагающаяся в одном из предсердий. Чаще всего растет на ножке, прикрепленной к межпредсердной перегородке;
- синдром гипоплазии левых отделов сердца (СГЛОС) – недостаточность развития всех элементов левого предсердия и желудочка;
- аномалия Эбштейна – составляет около 1% всех сердечных пороков. Представляет собой смещение створок трехстворчатого клапана в полость правого желудочка.
- Функциональные причины. К ним относятся появление шумов вследствие нарушения скорости кровотока, возникновения анемии и др…
Симптомы
Клиническая картина отсутствует в случае функциональных шумов в сердце. Потому и обнаружить отклонение (условно говоря) можно не всегда, чаще это случайная находка, которая становится поводом для углубленного исследования.
К сожалению, это не надежный диагностический признак. Потому как возможно бессимптомное течение и многих патологий.
На раннем этапе они проявляют себя объективным образом: изменением сердечного звука, артериального давления, частоты сокращений мышечного органа.
Характерные проявления на выраженных стадиях или при ярком течении первичного патологического процесса:
- Изменение цвета кожи. Довольно информативный момент, при тщательной оценке можно сказать узнать много важного.
Так, синюшность верхних и нижних конечностей указывает на стеноз аорты (может быть приобретенным нарушением или врожденной коарктацией), изменение цвета кончиков пальцев говорит о сердечной недостаточности и т.д.
Классический признак — сочетание посинения носогубного треугольника и общей бледности кожного покрова по всему телу с образованием видимого сосудистого рисунка.
- Тахипноэ или увеличение частоты дыхательных движений в минуту. На ранних стадиях патологического процесса обнаруживается при интенсивной механической нагрузке. В момент занятия физкультурой или активной игры.
По мере прогрессирования болезни, наступает суб-, а затем и декомпенсация, с сохранением одышки в полном покое.
Это негативный признак. Он указывает на общее нарушение, начало тяжелых органических изменений в легких, самом сердце. Скорее всего, поражен и головной мозг.
На это будут указывать неврологические симптомы: боли в затылочной, лобной, височной областях, вертиго с невозможностью ориентироваться в пространстве.
- Кашель. Приступообразный, непродуктивный. Развивается спонтанно на поздних стадиях. На ранних — в ответ на интенсивную физическую нагрузку.
- Периферические отеки. Сначала страдают голени, стопы. Затем все тело, что и указывает на декомпенсированную стадию патологического процесса.
В редких случаях возможен болевой синдром в грудной клетке по типу стенокардических.
Развивается при поражении коронарных артерий, что само по себе довольно редкое явление у детей. Распространенность — порядка 6.5-7% от общего числа молодых пациентов.
Как можно понять, логически размыслив, это симптомы не сердечных шумов, которые сами по себе считаются проявлением, а не болезнью. Речь идет о клинической картине на фоне первичного расстройства, которое обуславливает, в том числе и нарушения на аускультации.
Профилактика осложнений
Предупреждение возникновения шумов в сердце подразумевает профилактику сердечно-сосудистых заболеваний, начать которую необходимо еще до рождения ребенка. Так, беременной женщине важно соблюдать здоровый образ жизни, здорово питаться, не нервничать и не злоупотреблять алкоголем и никотином. Важно регулярно наблюдаться у гинеколога и проходить все назначаемые обследования, проконсультироваться у генетика.
При рождении ребенка профилактические мероприятия заключаются в следующих действиях:
- Своевременное лечение любых воспалительных заболеваний.
- Употребление овощей, фруктов и витаминов.
- Ограничение в употреблении жиров.
- Адекватная физическая нагрузка.
- Следить за количеством железа в крови.
Таким образом, соблюдения здорового образа жизни и правильного питания зачастую вполне достаточно для предупреждения многих заболеваний, связанных с шумами в сердце у детей.
Диагностика
Проводится кардиологом. Обычно в амбулаторных условиях, стационар требуется только при выраженных нарушениях самочувствия, для исключения избыточных рисков для ребенка. Проводить обследование стоит быстро, но тщательно.
Примерный перечень мероприятий:
- Устный опрос больного. Если молодой пациент еще не способен говорить, вопросы задают родителям. Важно определить симптомы, объективизировать и составить клиническую картину, чтобы выдвинуть гипотезы относительно происхождения расстройства.
- Сбор анамнеза. Перенесенные болезни, протекание родов, беременности у матери, семейная история, прочие моменты.
- Собственно аускультация. Позволяет констатировать факт, определить тип шума, этап его развития.
- Электрокардиография. Применяется для ранней оценки функциональных расстройств, аритмий, некоторых пороков.
- Эхокардиография. По сути это УЗИ кардиальных структур. Используется в рамках визуализации тканей. Дает возможность обнаружить анатомические дефекты.
- МРТ. Максимально информативный путь диагностики. Назначается в спорных случаях.
- Измерение артериального давления. В рамках патологических процессов отмечается стабильный рост показателя тонометра. Как только болезнь достигает определенного момента, обнаруживается падения уровня. Речь идет о суб- или декомпенсации.
- Суточное мониторирование по необходимости. Дает возможность оценить ЧСС и АД в динамике на протяжении 24 часов.
- Ангиография. Не всегда.
- Рентген грудной клетки.
- Анализы крови. Общий и биохимический с расширенной картиной жирных структур (липопротеидов высокой, низкой плотности, атерогенного индекса), также по мере надобности — уровня гормонов щитовидной железы, коры надпочечников.
Врачи с самого начала исходят из возможного болезнетворного происхождения расстройства.
ФСШ у ребенка — это не диагноз, а аускультативный звук функциональные шумы в сердце. Они являются вариантом нормы и не требуют лечения. Примерно в 12-13 годам все должно сойти на нет само. Точку в вопросе ставит диагностика.
Когда необходимо обследоваться?
Очень часто при первом обследовании новорожденного, ребенку ставят диагноз «шум в сердце» без расшифровки его природы. Для большинства родителей такой диагноз уже звучит как приговор. Но не стоит сразу впадать в панику. Любой шум в сердце требует уточнения причины его возникновения, а значит, ребенка нужно обследовать и наблюдать у врача-кардиолога. Не ждите, когда он «пройдет сам» (этого может и не произойти). В настоящее время основным методом изучения работы сердца является ультразвуковой – эхокардиография (эхо-КГ).
Электрокардиограмма (ЭКГ) поможет своевременно выявить нарушения работы сердца. Эхокардиограмма дополнит исследование, обнаружив причину нарушений.
Когда ребенок с «функциональными» шумами в сердце в течение многих месяцев (а то и лет) продолжает наблюдаться детским кардиологом или кардиоревматологом, но при этом ему не проводится ультразвуковое исследование сердца, ситуацию можно сравнить разве что с сидением на бомбе с часовым механизмом. Ведь без проведения этого обычного по теперешним временам исследования нельзя быть уверенным в том, что у ребенка под маской «функционального» шума не скрывается серьезная патология сердечно-сосудистой системы. Вряд ли найдется такой врач, который рискнет со стопроцентной уверенностью исключить порок сердца без проведения специального исследования. В то же время для опытного диагноста-инструменталиста не составит труда уточнить (подтвердить или опровергнуть) предположительный диагноз через считанные минуты.
Лечение
Терапии требуют органические шумы. Она может быть консервативной или оперативной. Зависит от исходной причины нарушения.
Медикаментозная методика основана на применении нескольких групп лекарственных средств:
- Противогипертензивные. Снижают уровень артериального давления (ингибиторы АПФ, бета-блокаторы, антагонисты кальция, диуретики мягкого действия, сберегающие калий, например, Верошпирон).
Наименований средств огромное количество. Однако самостоятельно невозможно выбрать безопасную схему. Потому нет и смысла уточнять названия.
При неграмотном применении не миновать сердечной недостаточности, почечной дисфункции.
- Гликозиды. Нормализуют сократительную способность миокарда. Используются непродолжительными курсами, восстанавливают кровоток. Но это временная мера в большинстве случаев.
Классические средства — Дигоксин, настойка ландыша. При неправильном (долгом) приеме или несоблюдении дозировок, вероятны фатальные побочные эффекты и осложнения.
Также возможно использование антиаритмических (Амиодарон), витаминно-минеральных комплексов и средств на основе микроэлементов, магния и калия (Аспаркам и аналоги).
В рамках экстренного купирования повышенного давления используется Капотен в количестве 1/6 – ¼ от таблетки. Важно, чтобы не было резкого падения показателя тонометра.
Хирургическая терапия показана в нескольких случаях: врожденные пороки самого сердца (камер, клапанов), сосудов (по типу заращения, закупорки, аномалий формы, анатомического развития).
Существует два способа доступа к измененному участку (операционному полю):
- Эндоваскулярный. Малотравматичный, путем нанесения точечных разрезов и введения хирургических инструментов. Требует высокой квалификации лечащего специалист, специального дорогостоящего оборудования, возможен не во всех случаях, только при малых размерах измененного очага или незначительных объемах вмешательства.
- Открытый доступ. В остальных ситуациях.
Суть лечения заключается в устранении сужения артерии (баллонирование или стентирование, механическое расширение), восстановление анатомической целостности при аномалиях тканей (пластика) или же протезирование (особенно часто при поражениях клапанов, когда другие способы смысла не имеют).
При грамотном походе удается добиться полного излечения. В дальнейшем рекомендуется какое-то время принимать препараты для нормализации реологических свойств крови, по необходимости также для снижения артериального давления.
Антифосфолипидный синдром у детей
Антифосфолипидный синдром (АФС) — системное аутоиммунное заболевание с артериальным или венозным тромбозом различной локализации, с невынашиванием беременности (спонтанные аборты, выкидыши, внутриутробная гибель плода) и с высоким титром патогенетически значимых антител к фосфолипидам (ФЛ), таких как антитела к кардиолипину (КЛ), антитела к волчаночному антикоагулянту (ВА) и антитела к кофакторным белкам (протромбин, протеин С, протеин S, аннексин V, простациклин и бета2-гликопротеин-I (бета2-ГП-I) [13].
Изучение АФС началось в 1907 г. с разработки Васcерманом лабораторного метода диагностики сифилиса. Впервые АФС описал в 1986 г. английский ревматолог Hughes G. R. V. С этого времени начинается интенсивное изучение патофизиологических и клинических особенностей АФС. Критерии диагностики АФС, которые были сформулированы в октябре 1998 г. на VIII международном симпозиуме, делятся на клинические и лабораторные (
.).
Клинические критерии АФС:
- Сосудистые тромбозы
Один или более клинических эпизодов артериального, венозного тромбоза или тромбоза сосудов малого диаметра, в любых тканях или органах. Тромбоз должен быть подтвержден картиной ультразвукового доплеровского сканирования или данными гистологического исследования, за исключением поверхностных венозных тромбозов. При гистологическом исследовании тромбоз должен быть представлен значительными изменениями сосудистой стенки невоспалительного характера.
- Заболевания беременных
- а) Один или более необъяснимых случаев смерти морфологически нормального плода на 10-й или позже неделе нормальной беременности, причем нормальная морфология плода должна быть документирована данными ультразвукового сканирования или непосредственным исследованием плода или
- b) Один или более случаев преждевременных родов морфологически нормального плода к 34-й или ранее неделе беременности вследствие тяжелой преэклампсии или эклампсии, или тяжелой плацентарной недостаточности или
- с) Три или более необъяснимых последовательных аборта до 10-недельного срока беременности. При этом без патологических или анатомических аномалий и/или гормональных нарушений у матери, причем хромосомные причины должны быть исключены у отца и матери.
Лабораторные критерии АФС:
- Умеренный или высокий уровень антител к КЛ класса IgG и/или IgМ в крови в двух или более исследованиях, полученных с интервалом не менее 6 недель, измеренных путем стандартного и иммуноферментного метода (ИФА) для бета2-ГП-I-зависимых антител к КЛ.
- Позитивный тест на наличие волчаночного антикоагулянта в плазме в двух или более исследованиях, полученных с интервалом не менее 6 недель [10].
Достоверный АФС диагностируется при наличии, по крайней мере, одного клинического и одного лабораторного критерия [5]. К сожалению, данные критерии разработаны для диагностики АФС у взрослых и не учитывают особенностей детского возраста.
Выявление АФС в педиатрии имеет важное прогностическое значение, поскольку предполагает высокий риск тромбозов, а также определяет течение и исход основного заболевания. Впервые ассоциации между наличием циркулирующего антикоагулянта и сосудистым тромбозам у детей были отмечены в 1972 г. у детей с системной красной волчанкой (СКВ) [10].
С 2000 года был создан официальный сайт «Европейский форум антифосфолипидных антител», где регистрируются дети с наличием антител к ФЛ. На основании данной базы в 2006 году была опубликована рабочая классификация АФС у детей.
Диагноз АФС для ребенка является достоверным при наличии клинического критерия и хотя бы одного лабораторного критерия.
Нужно отметить, что при подозрении АФС у детей важным критерием для постановки диагноза является семейный анамнез, наличие у родственников:
- ревматических заболеваний;
- рецидивирующих инсультов (особенно в возрасте до 50 лет);
- рецидивирующих инфарктов (особенно в возрасте до 50 лет);
- рецидивирующего тромбофлебита;
- невынашивания беременности, эклампсии и преэклампсии.
В исследуемых группах больных с АФС выявлены АФС-ассоциированные признаки заболевания: тромбоцитопения, мигрень или мигренеподобные головные боли, кровотечения из носа, сетчатое ливедо, эпилепсия, нарушения клапанного аппарата сердца, асептический некроз костей, хорея (гиперкинезы) и артериальная гипертензия. Данные проявления не являются клиническими критериями, но их наличие в совокупности с антителами к ФЛ представляет собой важный диагностический фактор для детей с АФС [14].
Выделяют несколько клинических вариантов АФС как у детей, так и у взрослых:
- Первичный АФС (ПАФС) — развивается у лиц без аутоиммунных заболеваний.
- Вторичный АФС (ВАФС) развивается у больных с ревматическими и аутоиммунными заболевания, со злокачественными новообразованиями, при применении ряда лекарственных препаратов (гормональных, контрацептивных, психотропных веществ, Новокаинамида, высоких доз интерферона альфа), инфекционных заболеваниях (герпесвирусная инфекция, микоплазмоз).
- Катастрофический АФС — мультисистемные, преимущественно органные тромбозы на уровне микроциркуляторного русла с высоким титром антител к ФЛ, диссеминированная внутрисосудистая активация с тромбозом в сосудах с небольшим диаметром, полиорганное поражение организма. Диагностирующим критерием для катастрофического АФС у детей является вовлечение в тромботический процесс не менее трех систем организма человека с гистологическим подтверждением микроваскулярной окклюзии и наличие антифосфолипидных антител (АФА).
- Неонатальный АФС. Это редкая патология имеет место у новорожденных детей при передаче тромботических факторов трансплацентарным путем от матерей с высокими АФА. Часто беременность на фоне высоких титров АФА разрешается мертворождением плода на раннем этапе гестации.
- Серологические варианты АФС — серопозитивный и серонегатвный АФС.
В настоящее время диагноз «серонегативный АФС» ставится с очень большой осторожностью, после исключения всех других возможных тромбофилий [2, 13].
Наиболее распространенными формами АФС у детей являются ПАФС и ВАФС.
J.-C. Pitte и соавт. (1993) разработали ряд критериев, исключающих ПАФС:
- Эритема лица (бабочка).
- Дискоидная эритема.
- Изъязвление слизистой рта или глотки.
- Артриты.
- Плевриты (без тромбоэмболии легочной артерии или левожелудочковой недостаточности).
- Перикардит (исключается инфаркт миокарда или уремия).
- Персистирующая протеинурия более чем 0,5 г/сут (наличие иммунокомплексного гломерулонефрита).
- Лимфопения менее 1000 клеток в 1 мкл.
- Антитела к нативной ДНК.
- Антитела к экстрагированным ядерным антигенам.
- Антинуклеарные антитела в высоком титре.
- Прием препаратов, индуцирующих выработку антител к ФЛ.
Антитела к ФЛ представлены различными классами (IgG, IgM, IgA) и имеют фосфолипидную специфичность. ФЛ — гетерогенная группа молекул с различным химическим строением и электрическим зарядом. К отрицательно заряженным ФЛ относятся: фосфатидилглицерин — КЛ, фосфатидилинозитол, а к нейтральным — фосфатидилхолин и фосфатидилэтаноламин. В клеточной мембране ФЛ образуют двойной слой с выраженной асимметрией. Отрицательно заряженные ФЛ создают поверхность, на которой происходит сборка ферментных комплексов двух основных звеньев коагуляционного каскада. В одном из них (теназный комплекс) фактор Х активируется комплексом факторов IXа и VIIa, а в другом — протромбиназная реакция — происходит конверсия протромбина в тромбин ферментным комплексом, состоящим из фактора Xa и Va (протромбиназный комплекс). Взаимодействие факторов IXa, Xa и протромбина с липидной поверхностью происходит посредством образования кальцийзависимого мостика между остатками гамма-карбоксиглютаминовой кислоты этих белков и отрицательно заряженными полярными группами ФЛ. Связывание с липидной поверхностью приводит к увеличению локальной концентрации и эффективного расположения коагуляционных факторов, что способствует максимальной скорости протекания реакции. Любые вещества, мешающие сборке этих комплексов на фосфолипидной поверхности, в том числе антитела к ФЛ, способны повышать уровень образования тромбина и нарушать свертывание крови. К ФЛ относится и ВА, который in vitro пролонгирует различные фосфолипидзависимые коагуляционные тесты [1, 10, 11].
Со времен Hughes G. R. V. существуют различные теории, объясняющие клеточные и молекулярные механизмы, с помощью которых антифосфолипидные антитела к ФЛ инициируют тромбозы. Одна из теорий предполагает активацию эндотелиальных клеток при присоединении антитела к ФЛ, что проявляется экспрессией молекул адгезии, увеличением секреции цитокинов и метаболизма простациклина.
Вторая теория базируется на оксидантзависимом повреждении сосудистого эндотелия. Окисленные липопротеиды низкой плотности (ЛПНП) захватываются макрофагами, что приводит к их активации, продукции цитокинов и последующему повреждению эндотелиальных клеток. Это подтверждает тот факт, что антитела к КЛ перекрестно реагируют с окисленными ЛПНП. Более того, антитела к ФЛ связываются с окисленным кардиолипином и, вероятно, распознают окисленные ФС, фосфолипидсвязывающие белки или и то и другое.
Третья теория предполагает, что антитела к ФЛ взаимодействуют с фосфолипидсвязывающими протеинами и/или модулируют их функции регулирования коагуляции. Этой теорией объясняются молекулярные механизмы влияния антител к ФЛ к кофакторным белкам: протромбина, протеина С, протеина S, аннексина V, простациклина и бета2-ГП-I [4].
Клинические признаки АФС разнообразны и зависят от локализации невоспалительной тромботической васкулопатии сосудистого русла.
При венозных тромбозах отмечается поражение глубоких вен нижних конечностей. У некоторых детей может развиться и тромбоз легочной артерии, правда, очень редко. Характерен тромбоз венозных сосудов почек, печени, глаз и мезентеральных сосудов.
Артериальный тромбоз у детей отмечается в церебральных артериях. Клиническая манифестация данной патологии — транзиторная ишемическая атака головного мозга или значительно реже встречающийся инсульт [2]. Тромботическая васкулопатия характерна для артерий почек, печени и мезентеральных сосудов. Локализация артериально-венозных тромбозов определяет разнообразие клинических проявлений АФС.
Высокий титр антифосфолипидных антител обусловливает широкий спектр патологии центральной и периферической нервной системы: транзиторная ишемическая атака головного мозга, окулярная нейропатия, внезапная тугоухость, парциальные судороги, эписиндром, хорея, транзиторная общая амнезия и психоз.
Ravelli A., Martini A. (2007) в своих исследованиях уловили значимое родство антител к КЛ класса IgM c цереброваскулярными проявлениями у детей с СКВ. Подобное исследование врачей из Торонто показало, что патогенетическим фактором у детей с СКВ являются антитела к бета2-ГП-I [8]. Наличие высоких титров антител к ФЛ характерно для детей с мультифокальным судорожным синдромом [7].
Педиатрический регистр больных с АФС (Ped-APS регистр) заявил о наличии ассоциации между гематологическими проявлениями и ВАФС у детей. Из них более частыми являются: тромбоцитопения, аутоиммунная гемолитическая болезнь и кровотечения. Клинические проявления поражения сердечно-сосудистой системы вариабельны и характеризуются поражением клапанов сердца, миокарда, артериальной гипертензией и внутрисердечными тромбами.
Кожные проявления АФС разнообразны и проявляются в первую очередь сетчатым ливедо — это сосудистая сеточка в виде синеватых пятен на голенях, ступнях, бедрах, кистях, особенно хорошо выявляемая при охлаждении. Возможна поверхностная сыпь в виде точечных геморрагий, напоминающих васкулит, или кровоизлияние в подногтевое ложе, подошвенная и ладонная эритема и кожные узелки. Наиболее тяжелые кожные проявления АФС — это некроз кожи дистальных отделов нижних конечностей и хронические язвы голеней.
По данным Европейской группы по изучению АФС у детей (Euro-Phosphpolipid Project Group) из 1000 детей с симптомами АФС у 53,1% был диагностирован первичный АФС. Наиболее характерными проявлениями АФС у детей являются венозные тромбозы, тромбоцитопения, livedo reticularis. Неврологическая симптоматика отмечается примерно у 20% больных [12].
По нашим данным ПАФС развивался чаще у мальчиков с отягощенной наследственностью (спонтанные аборты в анамнезе их матерей, инсульт, гипертоническая болезнь, варикозная болезнь, инфаркт миокарда). В клинических проявлениях преобладали симптомы поражения ЦНС на фоне более низких уровней антикардиолипиновых антител (АКА) и АФА класса IgG. ВАФС характеризовался клиническими признаками поражения почек, легких, кожи и наличием антител к ДНК (Рис.).
Необходимо отметить, что нередко выявляемое на фоне широкого спектра бактериальных и вирусных инфекций повышение уровня АФА (как правило, транзиторное) редко сопровождается развитием тромботических осложнений. Это связывают с различиями в иммунологических свойствах АФА при АФС и инфекционных заболеваниях: у больных с АФС формируются бета2-ГП-I-зависимые антикардиолипиновые антитела. Ряд вирусных инфекций (вирус Эпштейн–Барр, вирус герпеса и т. д.) способствуют повышению титра антител к ФЛ, поэтому для достоверности диагноза АФС у детей требуется наблюдение и контроль клинико-иммунологических показателей тромбоза в динамике [9, 13].
Ведение больных АФС представляет серьезную проблему. В основе АФС лежат различные патогенетические механизмы, приводящим к тромбозам. Гетерогенность клинических проявлений АФС, отсутствие общепризнанных клинических и лабораторных показателей, позволяющих прогнозировать рецидивирование тромботических проявлений, существенно усложняет выбор медикаментозной терапии больных с АФС. Например, развитие повторных тромбозов не всегда коррелирует с изменением титров антител к ФЛ и активностью основного заболевания при вторичном АФС.
Лечение больных АФС основывается на назначении непрямых антикоагулянтов и антиагрегантов (низкие дозы Аспирина), которые широко используются для профилактики тромбозов, не связанных с АФС. У больных с ВАФС, кроме того, проводится лечение основного заболевания. У пациентов с факторами риска повторных тромбозов в течение длительного периода должна проводиться интенсивная профилактика с использованием низкомолекулярного гепарина. Нужно отметить, что при венозных и артериальных тромбозах предпочтительно назначение варфарина и ацетилсалициловой кислоты в низких дозах, но при этом МНО (международное нормализованное отношение) должно сохраняться на уровне 2–3 (при венозных тромбозах) и > 3 (при артериальных). Включение ацетилсалициловой кислоты в комплексную терапию АФС приводит к нормализации свертывания крови и повышению количества тромбоцитов в периферической крови [4, 6]. В отдельных клинических наблюдениях или небольших открытых испытаниях сообщается об эффективности плазмафереза, введения внутривенного иммуноглобулина, простациклина, фибринолитических препаратов, препаратов рыбьего жира у женщин с акушерской патологией. Лечение плазмаферезом, высокими дозами глюкокортикоидами (в том числе пульс-терапия) и цитостатиками используется при лечении «катастрофического» АФС [4, 15].
Изучение механизмов развития, клинических особенностей и подходов к лечению АФС продолжает оставаться одной из наиболее актуальных мультидисциплинарных проблем современной медицины, для решения которой необходимо объединение усилий специалистов различных областей медицины — педиатров, ревматологов, кардиологов, невропатологов, акушеров-гинекологов, иммунологов.
Литература
- Баркаган З. С., Момот А. П. Диагностика и контролируемая терапия нарушений гемостаза. Изд. 2-е, дополненное. М.: Ньюдиамед, 2001.
- Калашникова Л. А. Неврология антифосфолипидного синдрома. М.: Медицина, 2003, с. 16–20
- Калинина Н. М., Дрыгина Л. Б., Соколян Н. А. Аутоиммунная патология эндотелия // Медицинская иммунология. 2004. Т. 6. № 1, 1–15.
- Насонов Е. Л. Антифосфолипидный синдром. М.: Литтерра, 2004, с. 337–343.
- Насонов Е. Л. Ревматология // Клинические рекомендации. М., ГЭОТАР-Медиа, 2008, с. 145–146.
- Решетняк Т. М. Антифосфолипидный синдром. Низкомолекулярные гепарины в терапии антифосфолипидного синдрома и новые перспективы. CONSILIUM-MEDICUM: Том 08 / N 2/2006.
- Asherson R. A. Primary antiphospholipid syndrome // J. Rheumatol. 1988. V. 15. P. 1742–1746.
- Asherson R. A. Harris E. N. Anticardiolipin antibodies-clinical association // Postgrad. Med. J. 1986. Vol. 62. P. 1081–1087.
- Avcin T., Cimaz R., Silverman E. D., Cervera R.., Gattorno M., Garay S., Berkun Y., Sztajnbok F. R., Silva C. A., Campos L. M., Saad-Magalhaes C., Rigante D., Ravelli A., Martini A., Rozman B., Meroni P. L. Pediatric antiphospholipid syndrome: clinical and immunologic features of 121 patients in an international registry//Pediatrics Nov. 2008; 122 (5): 1100–1107.
- Hanly J. G. Antiphospholipid syndrome // CMAJ. 2003, June 24; 168 (13): 1675–1682.
- Heshmat N. M., El-Kerdany T. H. Serum levels of vascular endothelial growth factor in children and adolescents with systemic lupus erythematosus // Pediatr Allergy Immunol. Jun 2007; 18 (4): 346–353.
- Piette J.-C., Cervera R., Font J. et al. Antiphospholipid syndrome: clinical and immunologic manifistations and patterns of disease expression in a cohort of 1000 patients // Arthritis Rheum. 2002. 46: 1019–1027.
- Ravelli A., Martini A. Antiphospholipid syndrome in pediatrics //Rheum Dis Clin North Am. Aug 2007; 3 (3): 499–523.
- Wilson W. A., Gharavi A. E., Koike T. International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome // Arthritis Rheum. 1999. 42: 1309–1311.
- Xiao H. J., Yang J. Y., Gao T. J., Huang J. P., Yao Y., Zhang Y. Clinical significance of antiphospholipid antibody in pediatric patients and review of literature // Zhonghua Er Ke Za Zhi. Aug 2004; 42 (8): 571–573.s
Г. А. Новик, доктор медицинских наук, профессор Н. М. Калинина, доктор медицинских наук, профессор Л. Н. Аббакумова, кандидат медицинских наук, доцент К. Г. Кикнадзе СпбГПМА, Санкт-Петербург
Купить номер с этой статьей в pdf
Прогноз
В случае с функциональными шумами прогноз всегда благоприятен. Это не заболевание и не проявление патологического процесса. Нарушений активности кардиальных структур, гемодинамических проблем нет.
Вне органических расстройств, анатомических дефектов также положительный. Удается добиться полного восстановления в 90-95% случаев.
Компенсированные пороки (не все) можно излечить в 80% ситуаций хирургическими методами.
В самых тяжелых случаях выживаемость составляет 30-40%, что все равно довольно много. Главное, что нужно помнить родителям — стоит внимательно следить за самочувствием ребенка, при необходимости срочно обращаться к кардиологу для прохождения полной диагностики.
Что такое спинальная мышечная атрофия и ее виды
Под этим термином объединяется несколько различных видов наследственных заболеваний, сопровождающихся ограничением двигательных способностей. Этим и объясняется тот факт, что в части случаев нарушения обнаруживаются не в младенческом возрасте, а у подростков или уже зрелых людей.
Впервые заболевание было описано в 1891 г. Г. Верднигом и в 1892 г. было выделено в отдельную нозологическую единицу Дж. Хоффманом, благодаря стараниям которых и получила свое второе название. Примерно через полвека Е. Кугелбергом и Л. Веландером была открыта другая подобная болезнь, развивающаяся в более позднем возрасте и отличающаяся более благоприятным течением.
Различают следующие формы патологии:
- СМА 0;
- СМА 1 (тяжелая форма);
- СМА 2 (промежуточная форма);
- СМА 3 (легкая форма);
- СМА 4 (поздняя форма).
Причина спинально-мышечная атрофии у детей
Все их объединяет то, что причина их возникновения кроется в мутации рецессивного гена 5 хромосомы SMN. Это приводит к сбоям в продукции протеинов в организме, являющихся строительным материалом всех клеток. В результате страдают мотонейроны спинного мозга и постепенно разрушаются. Поскольку без них невозможна передача нервных импульсов к мышечным волокнам, они постепенно атрофируются, что становится причиной утраты способности двигаться.
К счастью, даже при наличии у обоих родителей мутации гена SMNу них с 75% вероятностью может родиться здоровый ребенок. Но практически всегда он также будет носителем этого гена. Поэтому при планировании беременности стоит проходить генетическое исследование, особенно при наличии случаев СМА в семье.
СМА 0
Это врожденная болезнь, признаки которой обнаруживаются обычно еще в роддоме. Она встречается редко и ее часто объединяются со СМА-1. Для этого вида типично абсолютное отсутствие подвижности, слабость мышц, отсутствие сухожильных рефлексов и ограничение функциональности коленных суставов. С первых дней жизни ребенок страдает от нарушения дыхания.
Спинально-мышечную атрофию важно дифференцировать с перинатальной энцефалопатией и родовыми травмами, но если при них состояние детей постепенно улучшается, то при СМА оно не меняется. Более того часто присоединяются осложнения, которые практически всегда приводят к смерти младенцев в течение первого месяца жизни.
СМА 1 или болезнь Вердинга-Гоффмана
Этот тип течения спинальной мышечной атрофии характеризуется очень тяжелым протеканием. Обычно она обнаруживается до 6-ти месяцев и сопровождается слабостью мышц, периодическими спазмами, что сложно заметить в связи с особенностями анатомии детей первого года жизни (присутствия ярко-выраженной подкожно-жировой клетчатки).
Также заболевание проявляется регулярно пробегающей по языку дрожью, снижением рвотного, сосательного, глотательного рефлексов. Это приводит к возникновению серьезных трудностей при кормлении. Присутствует нарушение слюноотделения, кашель. Ребенок часто громко кричит.
Поскольку мышцы груди развиты недостаточно, можно заметить, что форма грудной клетки более плоская. Кроме того, дети с такой патологией лежат и спят в позе «лягушонка»: с отведенными в стороны плечами и бедрами при согнутых в коленях и локтях конечностях. Они способны к полугоду научиться держать голову (она часто имеет меньшие размеры, чем у здоровых детей), но им не под силу самостоятельно сидеть или принимать вертикальное положение тела.
Эта форма спинально-мышечной атрофии может сопровождаться олигофренией и врожденными пороками сердца. Дети подвержены тяжелым нарушениям дыхания, развитию воспаления легких. В связи с этим более половины детей не доживает до 2 лет и только 10% могут отметить свой 5-летний юбилей. Причиной смерти становятся пневмония, остановка сердца или дыхательная недостаточность.
СМА 2 или болезнь Дубовица
Заболевание обнаруживается у детей от 6 месяцев до 1,5–2 лет. Поэтому такую форму СМА часто называют поздней младенческой. Для нее типично:
- слабость и дрожь в мышцах;
- тремор пальцев, языка;
- скованность движений, обусловленная ограничением подвижности конечностей;
- задержка развития;
- недобор веса.
Дети с таким диагнозом способны самостоятельно сидеть, играть, есть, но стоять и передвигаться нет. К сожалению, патология склонна прогрессировать, что приводит к постепенному ослаблению мышц груди и шеи, следствием чего становится невозможность удерживать голову прямо и часто она безвольно свисает. Затем пропадают сухожильные рефлексы, слабеет голос и отмечаются нарушения акта глотания.
Длительность жизни при таком диагнозе составляет около 10–12 лет. Но треть больных погибает в возрасте до 4-х лет.
СМА 3 или болезнь Кугельберга-Веландера
Спинальную мышечную атрофию этого вида диагностируют обычно после 2 лет. Она так же проявляется слабостью мышц, но не в такой степени как при СМА 1 или даже СМА 2. Больные могут самостоятельно стоять, но только в течение короткого периода времени. В связи с атрофией мышц это дается им с трудом.
Несмотря на имеющееся заболевание, до 10–12 лет ребенок развивается нормально, что может ввести его родных в заблуждение и вызвать сомнения в правильности поставленного диагноза. Но, достигая этого временного рубежа, возникают первые признаки СМА. Ребенок начинает спотыкаться чаще обычного, падает и не может выполнять физическую работу или заниматься спортом, часто сталкивается с переломами. Постепенно бег, а затем и ходьба даются все сложнее из-за возникновения ограничения подвижности суставов. Впоследствии подросток теряет способность передвигаться без инвалидного кресла.
Прогрессирование патологии приводит к возникновению тяжелого сколиоза, что влечет за собой изменение формы грудной клетки и появление трудностей при дыхании. Именно в этом таится главная угроза болезни для жизни.
СМА 4
К этому типу заболевания относят несколько разных не влияющих на продолжительность жизни, но приводящих к инвалидизации амиотрофий:
- бульбоспинальную Кеннеди;
- дистальную Дюшена-Арана;
- перонеальную Вюльпиана.
Их объединяет то, что первые клинические признаки заболевания проявляются в период от 16 до 60 лет, чаще в 35–40 лет. Это сопровождается угасанием сухожильных рефлексов и заметными спазмами мышц. При атрофии Дюшена-Арана сильнее всего страдают кисти, а для болезни Вюльпиана характерно изменение формы лопаток на крыловидную.