Сократимость миокарда является способностью сердечной мышцы обеспечить ритмические сокращения сердца в автоматическом режиме с целью продвижения крови по сердечно-сосудистой системе. Сама сердечная мышца имеет специфическое строение, отличающееся от остальных мышц организма.
Элементарная сократительная единица миокарда – это саркомер, из них состоят мышечные клетки – кардиомиоциты. Изменение длины саркомера под воздействием электрических импульсов проводящей системы и обеспечивает сократимость сердца.
Нарушение сократимости миокарда может привести к неприятным последствиям в виде, например, сердечной недостаточности и не только. Поэтому, при возникновении симптомов нарушения сократимости, следует обратиться к врачу.
Особенности миокарда
Миокард обладает рядом физических и физиологических свойств, позволяющих ему обеспечивать полноценное функционирование сердечно-сосудистой системы. Эти особенности сердечной мышцы, позволяют не только поддерживать кровообращение, обеспечивая непрерывное поступление крови из желудочков в просвет аорты и легочного ствола, но также и осуществлять компенсаторно-приспособительные реакции, обеспечивая адаптацию организма к повышенным нагрузкам.
Физиологические свойства миокарда обуславливаются его растяжимостью и эластичностью. Растяжимость сердечной мышцы обеспечивает ее способность к значительному увеличению собственной длины без повреждения и нарушения своей структуры.
Справочно. От степени растяжимости миокарда во время диастолы (расслабления сердечной мышцы), зависит сила дальнейших сокращений миокарда в период систолы (сокращения сердечной мышцы, заканчивающегося изгнанием крови из полостей желудочков).
Эластические свойства миокарда обеспечивают его способность возвращаться в исходную форму и положение после того, как заканчивается воздействие деформирующих сил (сокращение, расслабление).
Также, важную роль в поддержании адекватной сердечной деятельности играет способность сердечной мышцы к развитию силы в процессе сокращения миокарда и совершению работы во время систолы.
Справочно. Физиологические особенности проявляются возбудимостью, сократимостью миокарда, его проводимостью и автоматизмом (автоматией).
Что такое сократительная способность миокарда
Сократимость сердца – это одно из физиологических свойств сердечной мышцы, реализующее насосную функцию сердца за счет способности миокарда сокращаться во время систолы (приводя к изгнанию крови из желудочков в аорту и легочной ствол (ЛС)) и расслабляться в период диастолы.
Важно. Сократимость миокарда отличается четкой последовательностью, поддерживающей ритмичность и непрерывность сердечных сокращений.
Вначале осуществляется сокращение предсердных мышц, а затем сосочковых мышц и субэндокардиального слоя желудочковых мышц. Далее, сокращение распространяется на весь внутренний слой желудочковых мышц. Это обеспечивает полноценную систолу и позволяет поддерживать непрерывный выброс крови из желудочков в аорту и ЛС.
Сократительная способность миокарда поддерживается также его:
- возбудимостью, способностью генерировать потенциал действия (возбуждаться) в ответ на действие раздражителей;
- проводимостью, то есть способностью проводить сгенерированный потенциал действия.
Сократимость сердца зависит также и от автоматизма сердечной мышцы, проявляющейся самостоятельной генерацией потенциалов действия (возбуждений). Благодаря этой особенности миокарда, даже денервированное сердце некоторое время способно сокращаться.
От чего зависит сократимость сердечной мышцы
Внимание. На сократимость миокарда (СМ) могут оказывать влияние нервная система, различные гормоны и лекарственные вещества.
Физиологические особенности сердечной мышцы регулируются блуждающими и симпатическими нервами, которые способны влиять на миокард:
- хронотропно;
- инотропно;
- батмотропно;
- дромотропно;
- тонотропно.
Текст книги «Основы физиологии сердца»
1.6. Сопряжение возбуждения и сокращения в миокарде
Фундаментальные свойства миокарда (возбудимость, проводимость и автоматия) обеспечивают его сократимость – способность мышечных волокон укорачиваться или увеличивать свое напряжение. В соответствии с теорией «скользящих нитей», предложенной X. Хаксли и А. Хаксли еще в 1950-х гг., при сокращении миофибрилл происходит укорочение саркомера, то есть уменьшение его продольного размера вследствие активного перемещения актиновых нитей относительно миозиновых. При этом длина нитей не изменяется. Молекулярными исследованиями 1970–1980-х гг. установлено, что актиновые нити скользят вдоль миозиновых благодаря «гребковым» движениям головок миозина. Головка прикрепляется к участку связывания на актине, потом наклоняется, вызывая укорочение саркомера, и отсоединяется от актина. Далее головка прикрепляется к следующему участку связывания на актиновой нити, и цикл повторяется. При этом сила сокращения определяется количеством связей (мостиков) между миозином и актином.
В расслабленном миокарде соединению миозина и актина препятствуют молекулы тропонина, «закрывающие» участки связывания на актиновой нити. Однако при повышении концентрации кальция в цитоплазме, что имеет место во время возбуждения кардиомиоцита, ионы кальция соединяются с тропонином С. Присоединение Са2+ к этому белку приводит к конформационным изменениям тропонин-тропомиозинового комплекса. В результате молекулы тропомиозина смещаются, миозиновые и актиновые нити вступают во взаимодействие, и начинается процесс сокращения. Чем больше ионов Са2+ поступит к миофибриллам при возбуждении, тем большее количество актомиозиновых мостиков будет образовываться, и тем сильнее, следовательно, будет сокращение. Таким образом, повышение концентрации ионов Са2+ в цитоплазме кардиомиоцита является ключевым фактором, обеспечивающим электромеханическое сопряжение – связь между возбуждением и сокращением миокарда.
Исследования, проведенные в 1980–1990-е гг., позволили установить, что на мембране Т-трубочек поверхностной мембраны кардиомиоцитов имеется кальциевый потенциалзависимый канал, который блокируется препаратами из группы дигидропиридинов. Поэтому он получил название дигидропиридинового рецептора (DHPR). На мембране терминальных цистерн саркоплазматического ретикулума расположен другой потенциалзависимый кальциевый канал, проницаемость которого модулируется растительным алкалоидом рианодином, поэтому он получил название рианодинового рецептора (RyaR). Кроме того, с последним, возможно, связан белок кальмодулин, конформационные изменения которого могут приводить к активации рианодинового рецептора и выходу ионов кальция из цистерн саркоплазматического ретикулума. По другим данным, рианодиновые рецепторы непосредственно активируются ионами кальция (рис. 7).
Рис. 7.
Транспорт ионов кальция в процессах сопряжения возбуждения и сокращения в сердечной мышце
Электромеханическое сопряжение в кардиомиоците начинается с возникновения фазы 0 потенциала действия на плазматической мембране. Когда мембранный потенциал достигает уровня –65 мВ, открываются потенциалзависимые Са2+-каналы L-типа, обеспечивающие формирование входящего ICa2+L тока, который ускоряет деполяризацию кардиомиоцитов. В результате активируются потенциалзависимые кальциевые ионные каналы мембраны T-трубочек (дигидропиридиновый рецептор), через которые ионы кальция поступают внутрь кардиомиоцитов. «Внешние» ионы кальция взаимодействуют (прямо или через посредство кальмодулина) с рианодиновыми рецепторами саркоплазматического ретикулума. Вследствие этого кальциевые ионные каналы саркоплазматического ретикулума открываются, и кальций начинает поступать из мембранных цистерн в цитоплазму кардиомиоцита. В результате концентрация кальция в цитоплазме клетки возрастает с менее чем 10-7 М/л до 10-5 М/л. Резкое повышение концентрации ионов Са2+ в саркоплазме устраняет тропомиозиновую блокаду взаимодействия актина и миозина и запускает процесс сокращения кардиомиоцитов.
Таким образом, поступление «внешних», или триггерных, ионов кальция вызывает высвобождение «внутренних» ионов кальция из саркоплазматического ретикулума. Такой процесс получил название кальций-индуцированного высвобождения кальция. Важно подчеркнуть, что чем более выраженным будет поступление внешних ионов кальция в цитоплазму кардиомиоцита, тем в большей степени будет возрастать количество ионов кальция, выходящих из саркоплазматического ретикулума. Поскольку входящий кальциевый ток ICa2+L достигает максимальной величины во время фазы 2 (плато) потенциала действия рабочего кардиомиоцита, длительность именно этой фазы в норме определяет силу сокращения миокарда. Следовательно, сократимость сердечной мышцы непосредственно зависит от силы входящего кальциевого тока (ICa2+L), которая может возрастать, например, под влиянием катехоламинов, влияющих на степень открытия кальциевых каналов L-типа. Наряду с этим поступление в цитоплазму внешних ионов кальция восполняет запасы кальция в цистернах саркоплазматического ретикулума, что в итоге также влияет на сократимость миокарда.
Существует и другой механизм поступления больших количеств ионов Са2+ в цитоплазму рабочего кардиомиоцита при его возбуждении. Он обеспечивается сопряженным транспортом ионов кальция и натрия через мембрану, то есть Са2+/Na+-обменом. Во время диастолы Са2+/Na+-насос активно удаляет из клетки ионы Са2+ в обмен на ионы Na+. При возбуждении кардиомиоцита направление Са2+/Na+-обмена меняется на противоположное: ионы Са2+ активно переносятся в клетку, тогда как ионы Na+, напротив, удаляются, и в результате концентрация ионов кальция в цитоплазме кардиомиоцита возрастает.
Нарушение процесса электромеханического сопряжения при патологии сердца может привести к тому, что потенциалы действия, продолжая возникать в синусовом узле и распространяться по проводящей системе к рабочему миокарду, не вызывают его сокращения. Отсутствие сократительной функции миокарда приводит к остановке кровообращения. Однако электрическая активность сердца может быть выявлена, например, с помощью регистрации электрокардиограммы. Такое состояние называется электромеханической диссоциацией и может явиться одной из непосредственных причин смерти, например при инфаркте миокарда.
Снижение сократимости миокарда является одной из основных причин развития сердечной недостаточности – состояния, при котором нарушаются гемодинамическая функция сердца и нормальное кровоснабжение органов и тканей. В клинической практике для лечения сердечной недостаточности применяют сердечные гликозиды – вещества, выделенные из таких растений, как наперстянка (дигиталис), строфант, ландыш и др. (Впервые в клиническую практику препараты наперстянки были внедрены английским врачом В. Уитерингом еще в 1785 г.) Как показали физиологические и фармакологические исследования, проведенные в середине 1970–1980-х гг., механизм действия этих препаратов обусловлен их способностью влиять на работу К+/Na+-насоса мембран кардиомиоцитов, а также метаболизм миокарда. В малых терапевтических дозах сердечные гликозиды усиливают работу К+/Na+-насоса, что отчасти увеличивает концентрацию ионов калия в клетках, вызывая увеличение его сократимости.
В средних и высоких терапевтических дозах данные препараты, напротив, угнетают К+/Na+-насос мембраны кардиомиоцитов, что приводит к возрастанию внутриклеточной концентрации Na+ и усилению поступления ионов Са2+ в клетку по механизму Са2+/Na+-обмена (как в покое, так и при возбуждении). В результате увеличивается продолжительность фазы плато потенциала действия рабочего кардиомиоцита, а следовательно, еще больше возрастает сократимость миокарда.
1.7. Особенности сократимости и биомеханики сердечной мышцы
Работа сердца как насоса обеспечивается прежде всего нормальной сократительной функцией миокарда. В исследованиях, проведенных в 1970–1980-х гг. на сосочковой (папиллярной) мышце миокарда млекопитающих, были предприняты попытки, во-первых, создать биофизические модели для описания параметров сократительной активности миокарда, таких как сила и скорость сокращения, а во-вторых, выявить взаимосвязь между указанными параметрами и показателями насосной функции сердца, например ударным объемом желудочков и сердечным выбросом. Эти модели сначала опирались на теорию сокращения скелетной мышцы, предложенную английским физиологом, лауреатом Нобелевской премии А. Хиллом еще в 1922 г. Однако, как оказалось, по ряду фундаментальных характеристик сократимости сердечная мышца отличается от скелетной.
Закон «все или ничего».
Поскольку миокард представляет собой функциональный синцитий, то при развитии потенциала действия в одном кардиомиоците процесс возбуждения с высокой скоростью (до 0,5 м/с) распространяется на соседние невозбужденные клетки. Таким образом, происходит быстрый охват возбуждением всех рабочих кардиомиоцитов, что обеспечивает синхронность и практически одновременность их сокращения. Вследствие этого сила сокращения сердца не зависит от силы сверхпорогового раздражителя (закон «все или ничего»). Этот закон был впервые сформулирован американским физиологом X. Боудичем в опытах с электростимуляцией изолированного сердца в конце XIX в.
Невозможность суммации сокращений (тетануса).
Как указано выше, продолжительность рефрактерного периода (абсолютного и относительного) рабочего миокарда примерно соответствует времени всего потенциала действия (300 мс). Принципиально важно, что длительность потенциала действия рабочих кардиомиоцитов практически совпадает по времени с продолжительностью их сокращения. Поэтому последующий импульс может вызвать сокращение миокарда только после его расслабления, что соответствует окончанию предыдущего потенциала действия. В результате в миокарде невозможна суммация сокращений при увеличении частоты стимуляции, то есть развитие тетануса, как в скелетной мышце, что могло бы привести к нарушению сокращения и остановке сердца. (Напомним, что продолжительность потенциала действия скелетной мышцы составляет около 5–10 мс, а длительность ее сокращения – 40–50 мс.) В скелетной мышце следующий импульс уже через 10 мс после первого может вызвать новое сокращение, когда мышца еще не расслабилась, что приводит к суммации сокращений. В миокарде этого не происходит в силу значительной продолжительности рефрактерного периода.
Зависимость силы сокращений от величины входящего тока кальция.
Выше говорилось, что сокращение миокарда возникает в ответ на поступление «внешних» ионов кальция, которые вызывают высвобождение «внутреннего» кальция из саркоплазматического ретикулума. Поэтому чем более выраженным будет входящий ток ICa2+L, тем большее количество ионов кальция будет выходить в цитоплазму через рианодиновый кальциевый канал-рецептор из саркоплазматического ретикулума, и тем большее количество актомиозиновых мостиков будет образовываться. Таким образом, именно величина входящего тока кальция ICa2+L и определяет силу сокращения рабочих кардиомиоцитов и миокарда в целом. Поскольку входящий кальциевый ток ICa2+L в норме достигает максимальной величины во время фазы 2 потенциала действия рабочего кардиомиоцита, длительность именно этой фазы определяет силу сокращения миокарда. Продолжительность фазы 2 может возрастать под влиянием агонистов β-адренорецепторов, – катехоламинов, выделяющихся из симпатических нервов сердца или циркулирующих в крови. Поэтому возбуждение таких рецепторов сопровождается усилением сократимости миокарда, что играет важную роль в нервной и гуморальной регуляции сердечной деятельности.
Зависимость «частота – сила».
Как уже отмечалось, даже при очень высоких частотах стимуляции миокард не способен к развитию тетануса (суммированного сокращения), характерного для скелетной мышцы. Такая особенность является следствием длительного рефрактерного периода кардиомиоцитов, совпадающего по времени с продолжительностью сокращения, и защищает сердце от преждевременных возбуждений и утомления. Однако еще в XIX в. американский физиолог X. Боудич в экспериментах с электростимуляцией изолированного сердца наблюдал увеличение силы сердечных сокращений при увеличении частоты стимуляции. Данная зависимость «частота – сила» получила название «лестницы Боудича», или хроноинотропного эффекта (греч.
chronos
– время,
inos
– сила). Возникновение хроноинотропного эффекта, возможно, связано с тем, что при высокой частоте стимуляции промежутки времени между сокращениями укорачиваются, вследствие чего не происходит полного удаления ионов Са2+ , поступивших в саркоплазму при очередном сокращении. В результате с каждым последующим сокращением концентрация внутриклеточного ионизированного Са2+ возрастает, и соответственно возрастает сила сокращений. Хроноинотропный эффект можно рассматривать как разновидность гомеометрической регуляции сердца, и она будет рассмотрена далее вместе с другими миогенными механизмами.
Зависимость «длина – сила».
Исследования на папиллярной мышце миокарда кошки показали, что при растяжении саркомера происходит выдвижение актиновых и миозиновых нитей из промежутков между ними. В результате увеличивается количество актин-миозиновых мостиков, которые могут образоваться при сокращении, и, следовательно, создаются условия для возрастания силы сокращения при большем растяжении миофибрилл. Максимальная сила сокращения достигается при исходной длине саркомера около 2,2 мкм. Вместе с тем при растяжении волокон миокарда имеет место и увеличение входящего кальциевого тока в ответ на активацию так называемых кальциевых каналов растяжения (англ.
stretch-activated channels
), которые были обнаружены не только в гладких мышцах, но и в миокарде.
Увеличение входящего кальциевого тока непосредственно вызывает повышение сократимости миокарда. Кроме того, в ответ на изменение исходной длины волокон миокарда возрастает чувствительность тропонина C к ионам кальция, что способствует активации большего количества актомиозиновых мостиков.
Таким образом, исходная длина волокон миокарда является ключевой детерминантой регуляции силы его сокращения. В интактном сердце об исходном растяжении волокон миокарда могут свидетельствовать такие показатели, как конечно-диастолическое давление и объем желудочков. Зависимость силы сокращения от степени предварительного растяжения миокарда была отмечена немецким физиологом О. Франком на сердце лягушки в 1895 г. и детально исследована на сердечно-легочном препарате собаки английскими физиологами С. Паттерсоном и Е. Старлингом в 1914 г. Значение «закона сердца» Франка – Старлинга для регуляции его насосной функции (гетерометрическая регуляция) будет подробно рассмотрено в связи с миогенной регуляцией деятельности сердца.
Зависимость «скорость – сила».
Исследования, проведенные А. Хиллом на скелетной мышце, позволили установить графическую гиперболическую зависимость между нагрузкой и скоростью мышечного сокращения, которая выражается уравнением Хилла:
где V
– скорость сокращения, см/с;
Р
– сила мышечного сокращения (нагрузка), гс; Р0 – максимальная возможная сила сокращения;
а
– константа, которая характеризует тепло, выделяющееся при укорочении мышцы, и зависит от КПД работы мышцы;
b
– константа, характеризующая скорость перехода химической энергии в механическую (константы
а
и
b
имеют соответственно размерности нагрузки и скорости).
Из этого уравнения следует, что если нагрузка на мышцу равна нулю (Р
= 0), то скорость ее сокращения максимальна и равна
V
max =
bР
0/
а
. Режим сокращения мышцы с постоянной силой (при постоянной нагрузке) называется изотоническим (греч.
isos
– равный,
tonos
– напряжение). Если же нагрузка на мышцу максимальна (
Р
=
P
0), то укорочение отсутствует, то есть
V
= 0, что соответствует состоянию максимального изометрического сокращения (греч.
isos
– равный,
metron
– мера, размер сокращения (напряжения)).
Однако исследования, выполненные на папиллярной мышце, показали, что в миокарде наблюдается отклонение гиперболической зависимости «сила – скорость», установленной для скелетной мышцы. Это обусловлено многими причинами. Во-первых, даже при постоянном объеме камер сердца при сокращении миокарда имеет место внутреннее укорочение центральных и одновременное растяжение периферических участков сердечной мышцы. Следовательно, в сердце отсутствует классическое изометрическое сокращение, при котором длина мышечных волокон остается постоянной. Вовторых, миокард как функциональный синцитий обладает неоднородностью строения, и поэтому одни саркомеры могут быть растянуты в большей или меньшей степени, чем другие. В-третьих, на характер зависимости «сила – скорость» в миокарде в большей мере, чем в скелетной мышце, влияют процессы активной релаксации (подробнее см. подразд. 1.10). Наконец, изменение гиперболической зависимости «сила – скорость» вызывают многие вещества, действующие на сердце, например адреналин, ионы кальция, препараты дигиталиса.
1.8. Сердечный цикл и его фазовая структура
Деятельность сердца как насоса представляет собой непрерывное в течение всей жизни человека последовательное чередование периодов сокращения (систолы) и расслабления (диастолы) предсердий и желудочков. Сменяющие друг друга систола и диастола составляют сердечный цикл. В покое частота сокращений сердца (ЧСС) у взрослого человека составляет 60–80 циклов в 1 мин, то есть каждый цикл продолжается около 0,8 с. Из этого времени около 0,1 с продолжается систола предсердий, около 0,3 с – систола желудочков, а остальное время (примерно 0,4 с) – общая диастола, или пауза сердца.
Впервые детальный фазовый анализ деятельности сердца был проведен американским физиологом К. Уиггерсом в первой трети XX в. Им были получены одновременные записи кривых изменения давления крови в аорте, левом желудочке и предсердии, а также объема левого желудочка. Сердечный цикл удобно рассматривать на диаграмме «давление – объем», которая получается при одновременной регистрации давления и объема в полости левого желудочка и их сопоставления на одном графике (рис. 8).
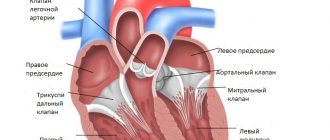
Во время общей паузы миокард расслаблен, и сердечные камеры заполняются кровью, поступающей из магистральных вен. Атриовентрикулярные клапаны в это время раскрыты, и кровь свободно поступает из предсердий в желудочки. Напротив, полулунные клапаны аорты и легочного ствола закрыты, поскольку диастолическое давление в этих сосудах значительно выше, чем в желудочках (давление в желудочках во время их диастолы близко к нулю) (участок А – В).
Генерация очередного импульса в синоатриальном узле вызывает электрическое возбуждение предсердий, что приводит к их сокращению. Клапаны между магистральными венами и предсердиями отсутствуют, поэтому для препятствия оттоку крови из предсердий обратно в вены во время систолы предсердий происходит сокращение кольцевой мускулатуры, окружающей устья полых и легочных вен. В течение систолы предсердий давление крови в них повышается и становится больше, чем в желудочках, которые в это время еще расслаблены (рис. 9).
За счет разности давлений из предсердий в желудочки переходит дополнительная порция крови, объем которой не превышает 15 % от общего наполнения желудочков за время диастолы. Движение крови при этом является турбулентным вследствие отражения от стенок желудочков. Такой характер потока крови облегчает закрытие атриовентрикулярных клапанов в начале систолы желудочков. С окончанием систолы предсердий заканчивается и диастола желудочков.
Рис. 8.
Изменения давления и объема крови в желудочках на протяжении сердечного цикла:
а
– в координатах «давление – время»;
б
– в координатах «давление – объем» (PV-диаграмма левого желудочка) А – В – период напряжения; В – С – период изгнания; C – D – период расслабления; D – A – период наполнения. Моменты времени: А – закрытия, С – открытия левого атриовентрикулярного клапана; В – открытия, D – закрытия аортального клапана. АДд – диастолическое артериальное давление, АДс – систолическое давление в аорте; КСД – конечно-систолическое, КДД – конечно-диастолическое давление в левом желудочке; КСО – конечно-систолический, КДО – конечно-диастолический объем желудочка; УОС – ударный объем сердца
Рис. 9.
Давление в сердечных полостях в разные фазы сердечного цикла:
а
– правая половина сердца;
б
– левая половина; верхние цифры – давление в предсердиях, нижние – давление в желудочках
К этому моменту в желудочках имеется определенное количество крови, которое образует конечно-диастолический объем и создает отличное от нуля конечно-диастолическое давление, определяющее преднагрузку сердца (нагрузка объемом).
Из предсердий возбуждение после атриовентрикулярной задержки с большой скоростью распространяется по проводящей системе желудочков, достигая рабочих кардиомиоцитов.
Начинается первый период систолы желудочков – период напряжения. Начальная фаза этого периода – фаза асинхронного сокращения – соответствует последовательному «включению» сократительных кардиомиоцитов. Внутрижелудочковое давление в эту фазу систолы растет незначительно. С момента охвата возбуждением всего миокарда желудочков начинается фаза изоволюмического сокращения, режим которого близок к изометрическому. Однако, как уже отмечалось, классического изометрического сокращения, при котором длина мышечных волокон остается постоянной, в интактном сердце не наблюдается. Даже при неизменном объеме камер сердца происходит внутреннее укорочение центральных и одновременное растяжение периферических участков сердечной мышцы. Кроме того, при сокращении сердца его стенки подвергаются деформации, что приводит к изменению длины мышечных волокон. Поэтому термин «изоволюмическое сокращение» применительно к этой фазе является более правильным и точным (рис. 10).
Оно характеризуется синхронным сокращением всех кардиомиоцитов в условиях, когда атриовентрикулярные клапаны уже закрыты, а полулунные еще не открылись, поскольку давление в аорте и легочном стволе в этот момент больше, чем в желудочках. Таким образом, желудочки оказываются изолированными с одной стороны от предсердий, а с другой – от сосудов. При этом объем желудочков остается постоянным. Фаза изоволюмического сокращения является важнейшей в деятельности сердца, поскольку именно в этот период сокращающийся миокард сообщает крови потенциальную энергию. Внутрижелудочковое давление в фазе изоволюмического сокращения нарастает с максимальной скоростью до 2000 мм рт. ст./с, и когда оно становится выше диастолического давления в аорте и легочном стволе, открываются полулунные клапаны, и начинается период изгнания крови из желудочков в магистральные артерии.
Рис. 10.
Изменение формы сердца при сокращении его отделов:
а
– разрез в поперечной плоскости. Пунктиром показаны контуры желудочков и отверстий;
б
– разрез во фронтальной плоскости; 1 – полулунные клапаны аорты; 2 – трехстворчатый клапан; 3 – двустворчатый клапан; 4 – полулунные клапаны легочной артерии; 5 – систола предсердий; 6 – систола желудочков
При изгнании крови потенциальная энергия, сообщенная ей миокардом, переходит в кинетическую. Вначале кровь в аорте и легочном стволе движется с большой скоростью (фаза быстрого изгнания), затем скорость движения крови уменьшается (фаза медленного изгнания). Это происходит потому, что кровь из сердца попадает в уже заполненные кровью аорту и легочный ствол; при изгнании крови из сердца она растягивает стенки данных сосудов (например, диаметр аорты увеличивается на 25 %). Кроме того, по мере изгнания крови уменьшается скорость сокращения миокарда. В фазе быстрого изгнания желудочки сокращаются в режиме, близком к изотоническому (с постоянной силой), давление крови в них возрастает незначительно по сравнению с периодом изоволюмического сокращения, тогда как их объем быстро уменьшается. По мере увеличения кровенаполнения аорты и легочных артерий давление в этих сосудах возрастает, достигая к концу систолы максимальной величины, которая называется систолическим давлением. Скорость движения крови из сердца после этого уменьшается, поэтому конечная фаза периода изгнания, как отмечалось ранее, называется фазой медленного изгнания. Иногда для обозначения фаз быстрого и медленного изгнания применяют термины фазы максимального и редуцированного изгнания соответственно.
К концу систолы желудочков в них остается некоторое количество крови (конечно-систолический, или остаточный, объем), которому соответствует и определенное давление крови (конечно-систолическое давление). После окончания сокращения желудочков начинается период расслабления. При этом давление в них, а также в аорте и легочном стволе начинает снижаться, причем в магистральных артериях за счет их эластических свойств, а также гидравлического сопротивления сосудов это происходит медленнее, чем в желудочках. Как только давление крови в желудочках становится меньше давления в аорте и легочном стволе, закрываются полулунные клапаны. Время от начала периода расслабления до закрытия полулунных клапанов называется протодиастолическим периодом (интервалом).
С момента закрытия полулунных клапанов желудочки, продолжая расслабляться, вновь становятся изолированными от аорты и легочного ствола, а также от предсердий, поскольку атриовентрикулярные клапаны в этот период еще закрыты. Это связано с тем, что давление в расслабляющихся желудочках пока еще выше, чем в предсердиях. Такой период диастолы получил название фазы изометрического, или изоволюмического, расслабления. Когда давление в желудочках снизится настолько, что станет меньше, чем в предсердиях, открываются атриовентрикулярные клапаны и начинается период наполнения желудочков, во время которого в них поступает кровь из предсердий. При этом давление, как в предсердиях, так и в желудочках, продолжает снижаться. Вначале кровь движется быстро (фаза быстрого наполнения). Именно в это время происходит основное кровенаполнение желудочков (около 85 %). Затем по мере наполнения желудочков давление в них возрастает, и движение крови замедляется (фаза медленного наполнения). Завершающая фаза периода наполнения желудочков ограничена наступающей систолой предсердий.
Правые и левые отделы здорового сердца сокращаются и расслабляются практически синхронно, то есть систола правого и левого предсердий, а также правого и левого желудочков начинается одновременно. При точном измерении временных характеристик фаз сердечного цикла в условиях эксперимента на животных и в клинике у человека можно наблюдать некоторый асинхронизм в работе правых и левых отделов здорового сердца. Так, систола правого предсердия начинается несколько раньше, а длится дольше, чем систола левого предсердия. Систола обоих желудочков начинается одновременно, но у правого желудочка она более длительная, чем у левого (за счет увеличения продолжительности фазы асинхронного сокращения), в то время как период расслабления, наоборот, дольше у левого желудочка. В норме эти расхождения в длительности фаз разных отделов сердца не превышают сотых долей секунды, однако могут заметно увеличиваться, например при нарушении проводимости миокарда.
Временные соотношения между описанными фазами приведены в табл. 3 и на рис. 11.
Рис. 11.
Схема двух последовательных сердечных циклов длительностью 0,8 с. Черным цветом обозначены периоды систолы предсердий и желудочков; заштрихованные участки соответствуют закрытию атриовентрикулярных и полулунных клапанов
Таблица 3
Примерная длительность (с) основных фаз сердечного цикла при частоте сердечных сокращений 75 мин– 1
Как регулируется сократимость миокарда
Воздействие блуждающих нервов вызывает снижение:
- сократимости миокарда,
- ЧСС,
- генерации потенциала действия и его распространения,
- метаболических процессов в миокарде.
То есть, оказывает исключительно отрицательные инотропные, тонотропные и т.д. эффекты.
Влияние симпатических нервов проявляется повышением сократимости миокарда, увеличением ЧСС, ускорением метаболических процессов, а также повышением возбудимости и проводимости сердечной мышцы (положительные эффекты).
Очень важно! Следует отметить, что сократимость миокарда также в значительной степени зависит от артериального давления.
При сниженном АД происходит стимуляция симпатического воздействия на сердечную мышцу, усиление сократимости миокарда и увеличение ЧСС, за счет чего осуществляется компенсаторная нормализация артериального давления.
При повышении давления происходит рефлекторное снижение сократимости миокарда и ЧСС, позволяющие понизить артериальное давление до адекватного уровня.
На сократимость миокарда также оказывает влияние значительная стимуляция:
- зрительных,
- слуховых,
- тактильных,
- температурных и т.д. рецепторов.
Это обуславливает изменение частоты и силы сердечных сокращений во время физической или эмоциональной нагрузки, нахождении в жарком или холодном помещении, а также при воздействии любых значимых раздражителей.
Из гормонов, наибольшее влияние на сократимость миокарда оказывают адреналин, тироксин и альдостерон.
Роль ионов кальция и калия
Также, изменять сократимость сердца могут ионы калия и кальция. При гиперкалиемии (избытке ионов калия) происходит снижение сократимости миокарда и частоты сердечных сокращений, а также торможение образования и проведения потенциала действия (возбуждения).
Ионы кальция наоборот способствуют увеличению сократимости миокарда, частоты его сокращений, а также увеличивают возбудимость и проводимость сердечной мышцы.
Препараты, оказывающие влияние на сократимость миокарда
Значительным влиянием на сократительную способность миокарда обладают препараты сердечных гликозидов. Данная группа препаратов способна оказывать отрицательный хронотропный и положительный инотропный эффект (основной препарат группы – дигоксин в терапевтических дозах повышает сократимость миокарда). Благодаря этим свойствам, сердечные гликозиды являются одной из основных групп препаратов, используемых в лечении сердечной недостаточности.
Также, на СМ способны оказывать воздействие препараты бета-блокаторов (снижают сократимость миокарда, оказывают отрицательный хронтропный и дромотропный эффекты), блокаторы Са каналов (оказывают отрицательный инотропный эффект), ингибиторы АПФ (улучшают диастолическую функцию сердца, способствуя увеличению сердечного выброса в систолу) и т.д.
Причины изменения состояния
Снижение силы сердечных сокращений может возникнуть как следствие ишемической болезни, особенно при перенесенном инфаркте миокарда. С этим заболеванием связано почти 70% всех случаев недостаточности кровообращения. Помимо ишемии, к изменению состояния сердца приводят:
- пороки врожденные или на фоне ревматизма;
- кардиомиопатия с расширением полостей (дилатационная);
- гипертоническая болезнь;
- сахарный диабет.
Степень снижения инотропной функции у таких пациентов зависит от прогрессирования основного заболевания. Кроме главных этиологических факторов, снижению резервных возможностей миокарда способствуют:
- физические и психологические перегрузки, стрессы;
- нарушение ритма;
- тромбоз или тромбоэмболия;
- воспаление легких;
- вирусные инфекции;
- анемия;
- хронический алкоголизм;
- снижение функции почек;
- избыток гормонов щитовидной железы;
- длительное применение медикаментов (гормональных, противовоспалительных, повышающих давление), чрезмерное поступление жидкости при инфузионной терапии;
- быстрый набор веса;
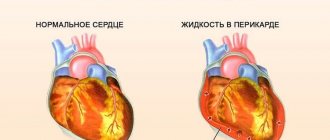
- миокардит, ревматизм, бактериальный эндокардит, скопление жидкости в околосердечной сумке.
При таких состояниях чаще всего удается практически полностью восстановить работу сердца, если вовремя устранить повреждающий фактор.
Чем опасно нарушение сократимости
Сниженная сократимость миокарда сопровождается уменьшением сердечного выброса и нарушением кровоснабжения органов и тканей. Вследствие этого, развивается ишемия, возникают метаболические нарушения в тканях, нарушается гемодинамика и увеличивается риск тромбообразования, развивается сердечная недостаточность.
Внимание! Резко сниженная глобальная сократимость миокарда сопровождается выраженным застоем крови в малом кругу кровообращения, появлением сильной одышки (даже в покое), кровохарканья, отеков, увеличения печени.
Когда может нарушаться СМ
Снижение СМ может отмечаться на фоне:
- гипоксии миокарда;
- ишемической болезни сердца;
- выраженного атеросклероза коронарных сосудов;
- инфаркта миокарда и постинфарктного кардиосклероза;
- аневризмы сердца (наблюдается резкое снижение сократимости миокарда левого желудочка);
- острых миокардитов, перикардитов и эндокардитов;
- кардиомиопатий (максимальное нарушение СМ наблюдается при истощении адаптационных возможностей сердца и декомпенсации кардиомиопатии);
- травм голоного мозга;
- аутоиммунных заболеваний;
- инсультов;
- интоксикаций и отравлений;
- шоков (при токсическом, инфекционном, болевом, кардиогенном и т.д.);
- авитаминозов;
- нарушения баланса электролитов;
- кровопотери;
- тяжелых инфекций;
- интоксикаций при активном росте злокачественных новообразований;
- анемий различного генеза;
- эндокринных заболеваний.
ЛФК
ЛФК при нарушениях преднагрузки и постнагрузки предусматривает умеренную физическую активность, которая не вызывает перенапряжение сердечной мышцы.
Ходьба
Неспешные прогулки — это наиболее щадящий режим лечебной физкультуры. При отсутствии противопоказаний со стороны врача-кардиолога рекомендуется ежедневно проходить по 1-2 км. На протяжении всего периода пешей ходьбы следует контролировать общее самочувствие, сердечный ритм, равномерность дыхания.
Езда на велосипеде
Прогулки на велосипеде является одним из направлений ЛФК. Езда на данном виде транспорта предусматривает соблюдение умеренного темпа, чтобы обеспечивалась тренировочная нагрузка на сердечную мышцу, но при этом не возникало приступов ее учащенного сокращения. В течение дня на велосипеде необходимо проезжать до 5 км.
Плавание
Занятия плаванием предусматривают серьезную кардиологическую нагрузку для сердца и кровеносных сосудов. Поэтому данный вид ЛФК проводится совместно с инструктором или под наблюдением медицинского работника.
Людям с признаками нарушения преднагрузки и постнагрузки рекомендуется посещение бассейна 2-3 раза в неделю с продолжительностью плавания 30-40 мин.
Нарушение сократимости миокарда – диагностика
Наиболее информативными методами исследования СМ являются:
- стандартная электрокардиограмма;
- ЭКГ с нагрузочными пробами;
- холтеровское мониторирование;
- ЭХО-К.
Также, для выявления причины снижения СМ выполняется общий и биохимический анализ крови, коагулограмма, липидограмма, оценивается гормональный профиль, проводится УЗИ почек, надпочечников, щитовидной железы и т.д.
СМ на ЭХО-КГ
Наиболее важным и информативным исследованием является ультразвуковое исследование сердца (оценивание объема желудочков во время систолы и диастолы, толщины миокарда, вычисления минутного объема крови и эффективного сердечного выброса, оценка амплитуды межжелудочковой перегородки и т.д.).
Оценка амплитуды межжелудочковой перегородки (АМП) относится к важным показателям объемных перегрузок желудочков. Нормокинез АМП находится в пределах от 0.5 до 0.8 сантиметров. Показатель амплитуды задней стенки левого желудочка – от 0.9 до 1.4 сантиметра.
Значительное увеличение амплитуды отмечается на фоне нарушения сократимости миокарда, при наличии у больных:
- недостаточности клапана аорты или митрального клапана;
- объемной перегрузки правого желудочка у пациентов с легочной гипертензией;
- ишемической болезни сердца;
- некоронарогенных поражений сердечной мышцы;
- аневризм сердца.
Нужно ли лечить нарушения сократительной способности миокарда
Нарушения сократимости миокарда подлежат обязательному лечению. При отсутствии своевременного выявления причин нарушения СМ и назначения соответствующего лечения, возможно развитие тяжелой сердечной недостаточности, нарушение работы внутренних органов на фоне ишемии, образование тромбов в сосудах с риском тромбозов (в следствии гемодинамических нарушений, связанных с нарушенной СМ).
Если понижена сократимость миокарда левого желудочка, то наблюдается развитие:
- сердечной астмы с появлением у больного:
- экспираторной одышки (нарушенный выдох),
- навязчивого кашля (иногда с розовой мокротой),
- клокочущего дыхания,
- бледности и цианоза лица (возможен землистый цвет лица).
Внимание. Нарушения СМ правого желудочка сопровождается появлением одышки, снижением работоспособности и переносимости физ.нагрузок, а также появлением отеков и увеличением печени.
Диагностика при нарушенной преднагрузке и постнагрузке
В таблице ниже представлены основные методы диагностического обследования, которые показаны к проведению пациентам с признаками нарушений преднагрузки и постнагрузки сердечной мышцы.
| Метод диагностики | Цель проведения обследования |
| ЭКГ | Электрокардиограмма отображает ритмическую активность сердца, а также первые признаки нарушения регулярности сокращений данного органа. Это простой, но при этом очень эффективный метод диагностики, который показывает снижение преднагрузки и постнагрузки сердечной мышцы. |
| Эхокардиография | Эхокардиография является усовершенствованным способом ультразвукового исследования, с помощью которого можно обнаружить патологические изменения в структуре тканей сердца. Например, повреждение его клапанного аппарата, утолщение стенок желудочков и другие виды кардиологических заболеваний. |
| Биохимический анализ венозной крови | Данный вид исследования необходим для того, чтобы обнаружить возможные изменения биохимического состава крови. Собранный биологический материал проверяется на возможное наличие инфекционных микроорганизмов, которые повредили ткани сердечной мышцы, что в последующем привело к нарушению преднагрузки и постнагрузки органа. |
Катетеризация сердца и его магистральных сосудов с целью определения кровеносного давления внутри желудочков сердца является радикальным метолом диагностики нарушений преднагрузки и постнагрузки, который применяется только в специализированных кардиологических центрах.
Лечение нарушений СМ
Все лечение должно подбираться врачом кардиологом, в соответствии с причиной нарушения СМ.
Для улучшения метаболических процессов в миокарде могут применяться препараты:
- рибоксина,
- милдроната,
- L-карнитина,
- фосфокреатина,
- витамины группы В,
- витамины А и Е.
Также могут использоваться препараты калия и магния (Аспаркам, Панангин).
Пациентам с анемиями показаны препараты железа, фолиевой кислоты, витамина В12 (в зависимости от типа анемии).
При выявлении нарушений липидного баланса может назначаться гиполипидемическая терапия. Для профилактики тромбообразования, по показаниям назначаются антиагреганты и антикоагулянты.
Также, могут использоваться препараты, улучшающие реологические свойства крови (пентоксифиллин).
Больным с сердечной недостаточностью могут быть назначены сердечные гликозиды, бета-блокаторы, ингибиторы АПФ, мочегонные средства, препараты нитратов и т.д.
Классификация заболевания
По длительности развития симптомов поражения сердечная недостаточность делится на острую и хроническую. Первая из них может развиваться по одному из двух типов:
- Левому — левожелудочковая или левопредсердная.
- Правому — правожелудочковая.
Сердечно сосудистая недостаточность классифицируется, согласно Василенко-Стражеско на три стадии:
- Первая. Это начальная стадия, характеризующаяся тем, что скрытые симптомы становятся заметными только, если человек физически активен. У него появляется одышка, учащенное сердцебиение. Больной быстро утомляется. При отсутствии физических нагрузок эти признаки отсутствуют.
- Вторая. Симптомы долгой недостаточности кровообращения и застоя всей сердечно-сосудистой системы проявляются и тогда, когда человек находится в состоянии покоя. Пациент считается нетрудоспособным. У этой стадии есть два периода. 2-й А характеризуется умеренными гемодинамическими поражениями в одном из разделов органа. Это левый или правый желудочек. Проявления одышки наблюдается даже при нормальной физической нагрузке. Работоспособность у пациента падает. Другие проявления — цианотичный цвет кожи, отечность ног, тяжелое дыхание. 2-й Б А характеризуется серьезными нарушениями. В этот процесс втянуты вся сердечно-сосудистая система. Внешние проявления — человек ощущает одышку даже находясь в состоянии покоя. Появляются отеки, цианоз. Пациент полностью нетрудоспособен.
- Третья. Эта конечная стадия характеризуется значительным ухудшением циркуляции крови и обмена веществ. Структура многих органов, в частности, печени, легких, безвозвратно нарушается. У пациента наблюдается истощение.
Низкий пульс: причины и признаки
В случае, если у больного наблюдается острая сердечная недостаточность, у него ослаблена деятельность какого-либо отдела сердца. Это может быть левое предсердие, один из желудочков. Недостаточность левого желудочка появляется при наличии болезни, оказывающей нагрузку на этот отдел. Это может быть гипертония, инфаркт.
При этом наблюдается повышение давления в некоторых кровеносных сосудах, увеличение их проницаемости. Следствием этого является отек интерстициальный, переходящий в альвеолярный. Проявляется подобный вид недостаточности в виде сердечной астмы. Наблюдается также альвеолярный отек легких.
Обострение астмы, как правило, побуждает чрезмерная физическая активности либо большое эмоциональное напряжение. Чаще всего человек ощущает сильное и внезапное удушье ночью, во время сна. В результате больной в ужасе просыпается.
Проявляется подобный вид астмы ощущением недостатки кислорода, повышенным сердцебиением, мокрым кашлем, сильной слабостью. Пациент во время приступа покрывается холодным потом, в положении лежа у него появляется сильная одышка.
Специалист, проводящий осмотр, отмечает, что поверхность кожи посерела, становится синюшной, у человека одышка, холодный пот. Пульс становится слабым, аритмичным. Границы сердца расширяются влево. Артериальное давление уменьшается. При прослушивании легких наблюдается жесткое дыхание.
Происходит увеличения застоя в малом круге кровообращения. В результате развивается отек легких. Больной испытывает состояние удушья, при этом выделяется мокрота. Она пенистая, имеет розоватый оттенок, очень обильная.
Это происходит из-за того, что в ней присутствует кровь. Даже посторонние люди слышат тяжелое хриплое дыхание с клокотанием. Пациент вынужден находиться в вертикальном положении, так как в горизонтальном у него усиливается одышка.
Лицо приобретает синюшный оттенок, вены на шее набухают, пациент покрывается холодным потом. Пульс учащенный, нитевидный, давление понижено, при дыхании раздаются хрипы. Если появляется отек легких, требующий неотложного вмешательства, необходимо принимать меры интенсивной терапии. Иначе все может кончиться очень печально.
Острая сердечная недостаточность левого предсердия наблюдается в случае митрального стеноза. Проявление заболевания аналогичны тем, что встречаются при заболевании левого желудочка.
Поражение правого желудочка обычно является следствием тромбоэмболии сосудов легочной артерии. В большом круге кровообращения появляются застойные явления. В результате начинают отекать ноги, набухать вены шеи, появляется одышка, кожа приобретает синюшный оттенок, в области сердца давит и болит. Происходит резкое снижение артериального давления, расширение сердца вправо.
Если у пациента болезнь, приводящая к неправильному функционированию правого желудочка, проявление сердечной недостаточности появляется раньше, чем, если то же самое происходит с левым желудочком. Ведь этот отдел сердца считается самым мощным. Но, если наблюдается снижение его функций, развитие сердечной недостаточности идет очень быстро.
Хроническая сердечная недостаточность характеризуется тем, что на в самом начале ее развитие может осуществляться по любому типу — право- и левопредсердному, право- и леаожелудочковому. Если есть порок аорты, артериальная гипертензия, некоторые другие недуги, в сосудах малого круга кровообращения отмечаются застойные явления, приводящая к недостаточности левого желудочка.
При этом в легких происходят изменения сосудов. У человека появляется одышка, удушье (обычно в ночное время), синюшный цвет кожи. Отмечается повышенной сердцебиение, сухой кашель, пациент очень быстро утомляется.
При проблемах с левым предсердием появляется сильный застой малого круга. Это случается у людей, имеющим стеноз митрального клапана. У пациента наблюдается одышка, он постоянно кашляет, начинает харкать кровью.
Если застой в венах продолжается долгое время, в сосудах и легких отмечается склероз. Циркуляция крови в малом круге ухудшается, так как появляется дополнительное препятствие. Нагрузка на правый желудочек возрастает, именно этим обстоятельством объясняется возникновение недостаточности.
Если в основном поражению подвергся правый желудочек, застой охватывает большой круг. Заболевание такого типа может явиться следствием митральных сердечных пороков, пневмосклероза, других недугов. Пациент начинает жаловаться на то, что под правым ребром у него болит, чувствуется тяжесть.
У него появляются отеки, увеличивается живот, при даже небольшой физической активности возникает одышка. Снижается диурез, кожа приобретает цианотичный оттенок. Наблюдается набухание вен шеи, увеличение печени.
Поражение, которое касается лишь одного отдела сердца, через некоторое время распространяется и на другие. Так возникает тотальная хроническая сердечная недостаточность, симптомы и лечение которой проводить должен специалист кардиолог.
Низкий пульс (брадикардия) не всегда возникает на фоне серьезных патологий. Иногда такое состояние может иметь чисто физиологическое происхождение. Но часто именно снижение частоты сердечного ритма – первый признак многих тяжелых заболеваний.
- Причины брадикардии
- Признаки
- Низкий пульс при низком давлении – что делать
- Сниженный сердечный ритм при повышенном АД – что делать
- Как повысить пульс
- Что делать в домашних условиях
| Низкий пульс – что делать в домашних условиях? |
| Пульс 90: это нормально или нет |
Причины высокого пульса при пониженном давлении Норма пульса у женщин в зависимости от возраста Низкий пульс при нормальном давлении: как повысить сердечный ритм - частый признак вегето-сосудистой дистонии;
- неврозы;
- опухоли, ушибы мозга, менингит;
- почечные колики;
- гипотиреоз;
- курение.
Причины брадикардии
Пульс меняется под влиянием различных факторов, в том числе температуры тела и воздуха, эмоционального состояния. Частота сердечного ритма зависит от возраста. Например, максимальные показатели бывают у детей дошкольного возраста – более 100 уд/мин.
Какой показатель считается низким? Брадикардию диагностируют при регулярном снижении сердечного ритма ниже 55 уд/мин. Патология часто свидетельствует о наличии различных заболеваний. Брадикардия бывает экстракардиальной и органической.
Когда возникает экстракардиальная брадикардия:
Часто пульс снижается у людей, которые голодают, применяют монодиеты. Снижается количество сердечных сокращений и при сильном давлении на сонную артерию. Органическая брадикардия развивается на фоне кардиосклероза, инфаркта, приема некоторых лекарств.
Очень низкий пульс (менее 40 уд/мин) свидетельствует о сильной интоксикации, которая возникает при сепсисе, вирусном гепатите, тифе. Сильно снижается сердечный ритм при повышенном содержании в крови кальция и калия, при отравлении фосфатами, продуктами распада белка.
У ребенка брадикардия может иметь физиологический характер – пульс снижается во время сна и покоя, после длительного пребывания в холодной воде или помещении. При отсутствии внешних раздражителей уменьшение частоты сердечных сокращений чаще всего вызвано повышенным тонусом блуждающего нерва, что бывает при проблемах с сердечной мышцей.
У подростков пульс снижается из-за быстрого увеличения размеров сердца, на фоне гормональной перестройки и нарушенного обмена веществ, переутомления.
Почему низкий пульс опасен? При брадикардии мозг и внутренние органы испытывают постоянный дефицит кислорода, что может стать причиной развития необратимых патологических состояний. Снижение сердечного ритма ниже 30 уд/ мин может привести к обмороку. Наиболее опасные осложнения – отек мозга, кома, остановка сердца.
Признаки
Незначительное снижение частоты сердечных сокращений практически никак не отражаются на самочувствии. При снижении пульса ниже отметки 50 уд/мин состояние человека может резко ухудшиться.
Симптомы брадикардии:
- болит голова, начинается сильное головокружение;
- человек становится вялым, появляется слабость;
- полуобморочное состояние, возможна потеря сознания;
- боль в грудине, одышка;
- аритмия.
Если снижение сердечного ритма вызвано проблемами со щитовидной железой, то к основным признакам добавляется тремор пальцев, мышечная слабость, человек резко теряет вес.
При сердечных патологиях низкий пульс сопровождается повышенной утомляемостью, которая не проходит даже после полноценного отдыха, увеличивается потоотделение, отекают конечности.
Гипотония в сочетании с низким пульсом – частый признак серьезных болезней, иногда такое состояние опасно для жизни.
Причины подобного состояния:
- инфаркт – снижается диастолическое давление, возникает сильная боль за грудиной;
- тромбоэмболия легочной артерии;
- анемия, неврозы, нарушение обменных процессов – часто сопровождаются обмороками и коллапсом;
- сильная кровопотеря, кровотечения;
- отек Квинке;
- инфекции, интоксикация.
При гипотонии и низком пульсе не следует спешить принимать лекарственные препараты. Иногда достаточно прилечь, выпить зеленый чай или крепкий натуральный кофе с сахаром. Если самочувствие позволяет, можно пройтись пешком быстрым шагом или сделать небольшую зарядку.
При незначительном снижении показателей пульса человек ощущает только симптомы высокого давления – мигрень, звон в ушах, одышка, тошнота. При этом кожные покровы покрываются красными пятнами, возникают приливы жара. Если пульс снижается ниже 50 уд/мин, то начинается головокружение, возможна потеря сознания.
Почему снижается пульс при гипертонии:
- сердечные патологии – эндокардит, порок сердца, ишемия, кардиосклероз;
- вегето-сосудистая дистония;
- разного рода опухоли;
- эндокринные болезни, гормональные колебания;
- умственные и физические перегрузки.
Иногда брадикардия – побочный эффект после приема лекарственных препаратов для нормализации давления.
[/idea]Важно! Если высокое артериальное давление сопровождается брадикардией, то не следует принимать никаких лекарственных препаратов до приезда врачей – это может только усугубить ситуацию.[/idea]